题目内容
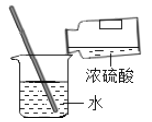
【题目】反应物的质量比不同可能会影响生成物的种类,为探究碳还原氧化铜生成的气体种类,设计了下列实验(所有反应均充分进行,浓硫酸用以吸收水蒸汽):
(提出问题):碳还原氧化铜生成的气体是什么?
(作出猜想):猜想①:CO 猜想②:CO2 猜想③:CO2和CO
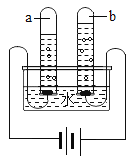
(实验设计):装置图如图
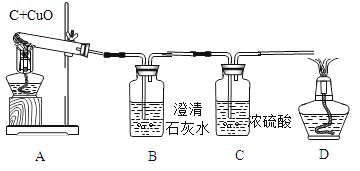
方案一:从定性观察角度判断:
①实验时,A中出现_________________的现象。
②若猜想①成立,B、D处的实验现象是:
B________________,D_________________。
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(试管+固体) | m1 | m2 |
B+C(广口瓶+溶液) | m3 | m4 |
③若猜想②成立,则(m4-m3)_____(m1-m2)(选填“>”、“<”、“=”)。此时A中发生反应的化学方程式为_____________________________。
④若猜想③成立,且8gCuO全部参与反应,则碳的物质的量(n)的取值范围是____<n<_____。
【答案】黑色固体逐渐变红 产生气泡 气体燃烧,产生淡蓝色火焰 = 2CuO+C![]() 2Cu+CO2↑ 0.05mol 0.1mol
2Cu+CO2↑ 0.05mol 0.1mol
【解析】
①实验时A处高温条件下,氧化铜和碳反应生成铜和碳的氧化物,实验现象是黑色固体逐渐变红。
故填:黑色固体逐渐变红。
②若猜想①成立,一氧化碳不溶于澄清石灰水,B产生气泡,D处一氧化碳燃烧生成二氧化碳,发出蓝色火焰。
故填:产生气泡;气体燃烧,产生蓝色火焰。
③若猜想②成立,m4-m3和m1-m2都是反应生成的二氧化碳质量,因此(m4-m3)=(m1-m2);
此时A中氧化铜和碳反应生成铜和二氧化碳,发生反应的化学方程式是:2CuO+C![]() 2Cu+CO2↑。
2Cu+CO2↑。
故填:=;2CuO+C![]() 2Cu+CO2↑。
2Cu+CO2↑。
④设8g氧化铜和碳反应全部生成铜和二氧化碳时碳的物质的量为x,8g氧化铜和碳反应全部生成铜和一氧化碳时碳的物质的量为y,
8g氧化铜的物质的量为:8g÷80g/mol=0.1mol,
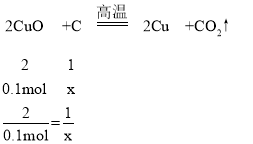
x=0.05mol,
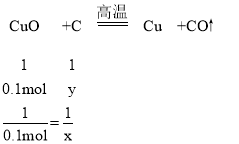
y=0.1mol,
若猜想③成立,且8gCuO全部参与反应,则碳的物质的量(n)的取值范围是0.05mol<n<0.1mol。
故填:0.05mol<n<0.1mol。

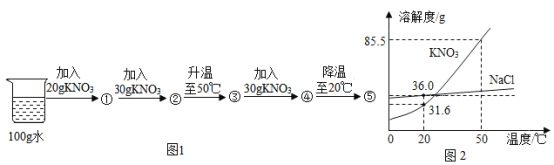
【题目】NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)10℃时,在100 g水里溶解_________g KNO3时,溶液恰好达到饱和状态。
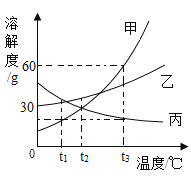
(2)右图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
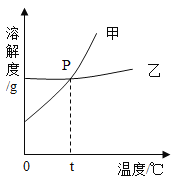
A.10℃~20℃ B.20℃~30℃
C.30℃~40℃ D.40℃~50℃
(3)10℃时,分别在100 g水中加入35 g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变