题目内容
【题目】质量相等的四种物质①H2O2②KMnO4③KClO3④H2O,完全分解后所制得氧气的质量由大到小的顺序为_____(填序号,下同);四种金属①Zn②Mg③Al④Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,则投入金属的质量由小到大的顺序为_____。
【答案】④①③② ①④②③
【解析】
根据所给物质写出这4个反应的化学方程式,按O2的化学计量数为1进行配平;计算每种物质与O2的质量比,然后比较得出答案。
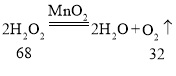
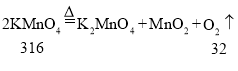
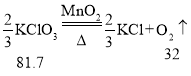

生成32克的O2所需H2O2、KMnO4、KClO3、H2O 4种物质的质量分别为68g、316g、81.7g、36g,所以完全分解后所制得氧气的质量由大到小的顺序为④①③②。
Zn、Mg、Al、Fe分别投入质量相等且足量的稀硫酸中,充分反应后所得四种溶液的质量相等,说明溶液质量增加的质量相等,即加入的金属质量减去生成的氢气的质量相等,
设锌的质量为a,镁的质量为x,铝的质量为y,铁的质量为z,则:
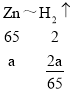
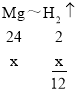
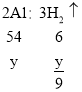
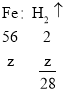
则![]()
即![]() ,故a<z<x<y,即m(Zn)<m(Fe)<m(Mg)<m(Al),
,故a<z<x<y,即m(Zn)<m(Fe)<m(Mg)<m(Al),
故投入金属的质量由小到大的顺序为①④②③。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目