题目内容
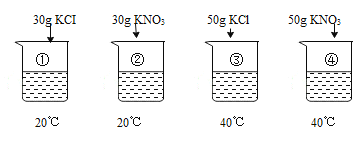
【题目】已知:烧杯中的水均为100g,表是KC1、KNO3在不同温度时的溶解度。
温度 | 20℃ | 40℃ |
KC1 | 34.0g | 40.0g |
KNO3 | 31.6g | 63.9g |
①~④所得溶液属于饱和溶液的是
A.①B.②C.③D.④
【答案】C
【解析】
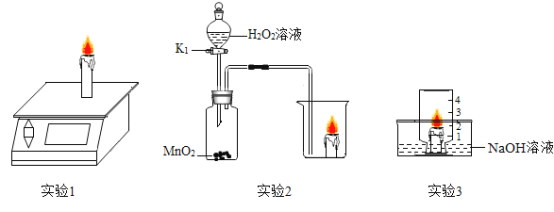
A、20℃时,氯化钾的溶解度为34.0g,即100g水中最多溶解34g氯化钾,而烧杯①中是100g水中加入30g氯化钾,小于34.0g,所以形成的是20℃时的不饱和溶液。故A不符合和题意;
B、20℃时,硝酸钾的溶解度为31.6g,即100g水中最多溶解31.6g硝酸钾,而烧杯②中是100g水中加入30g硝酸钾,小于31.6g,所以形成的是20℃时的不饱和溶液。故B不符合和题意;
C、40℃时,氯化钾的溶解度为40g,即100g水中最多溶解40g氯化钾,而烧杯③中是100g水中加入50g氯化钾,大于40g,不能全部溶解,所以形成的是20℃时的饱和溶液。故C符合和题意;
D、40℃时,硝酸钾的溶解度为63.9g,即100g水中最多溶解63.9g硝酸钾,而烧杯④中是100g水中加入50g硝酸钾,小于63.9g,所以形成的是20℃时的不饱和溶液。故D不符合和题意;
故选C。

【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。
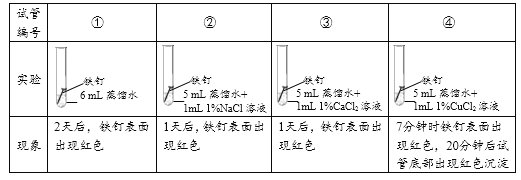
(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。