��Ŀ����
����Ŀ��ij��ѧ������ȤС��������80g��������Ϊ12%������������Һ��������Ҷ����ǩ����
��1����Ҫ�������ƹ��������Ϊ__________g��
��2������ʱ���������ƹ���Ӧ����__________�����ֽ�����ձ������С�
��3������˵���������ȷ����__________������ĸ��ţ���
A���Ƹ���Һʱ����IJ��������в�����������
B������Ϊ100mL����Ͳ��ȡ����Ҫ��ˮ
C�������õĹ��嵹��װ��ˮ����Ͳ���ܽ�
��4������ȡˮ�����ʱ�����������ӵķ����������������Ƶ�����������Һ�����ʵ�����������__________���ƫ��ƫС������
��5��ijͬѧ������ˮ��ʪ�˵�pH��ֽ���ⶨ���ƺõ���Һ��pHֵʱ������õĽ����__________���ƫ��ƫС�����䡱����
��6������ȤС���ͬѧ��������������ƺõ�����������Һ��ϡ��������кͷ�Ӧʵ�飬�����������ͼ��
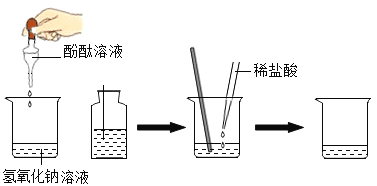
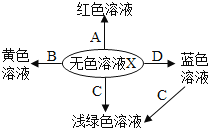
���ձ��м���10mL������������Һ�����뼸�η�̪��Һ����ʱ��Һ��__________ɫ�����ż���һ������ϡ���ᣬ�ò��������������ҺΪ��ɫ����ʱ__________����ܡ����ܡ����ó�����ǡ���к͵Ľ��ۡ����²�����ʵ��������֤�����������Ϊ��������__________������ĸ��ţ���
A�����������ۣ�����������
B�μ���ɫʯ����Һ���������Һ����
C����̼������Һ����������
���𰸡�9.6 �ձ� B ƫС ƫС �� ���� C
��������
��1����������=��Һ���������ʵ���������������80g��������Ϊ10%������������Һ�����������Ƶ�����=80g��12%=9.6g��
��2���������ƾ��и�ʴ�ԣ�����ʱ���������ƹ���Ӧ�����ձ��С�
��3��A�����Ƹ���Һʱ����IJ��������а�������������Ҫ���������裬�����ܽ⣬��ѡ�����
B���ܼ�����=��Һ����-��������������������ˮ������=80g-9.6g=70.4g��ˮ���ܶ�Ϊ1g/cm3�������V=![]() =
= ![]() =70.4cm3=70.4mL��������Ϊ100mL����Ͳ��ȡ����Ҫ��ˮ����ѡ����ȷ��
=70.4cm3=70.4mL��������Ϊ100mL����Ͳ��ȡ����Ҫ��ˮ����ѡ����ȷ��
C���ܽ�Ӧ���ձ��У���Ͳֻ����ȡҺ�壬��ѡ�����ѡB��
��4������ȡˮ�����ʱ�����������ӵķ����������������Ƶ�����������Һ�����ʵ�����������ƫС����Ϊ��ȡ��ˮ���ˡ�
��5������������Һ�Լ��ԣ�����Һ��pH����7ʱ���ʼ��ԣ���pHԽ����Խǿ��������ˮʪ��pH��ֽ������ϡ���˴�����Һ��ʹ����������Һ�ļ��Լ������ⶨ���ƫС��
��6������������Һ�Լ��ԣ���ʹ��̪��Һ���ɫ�����ż���һ������ϡ���ᣬ�ò��������������ҺΪ��ɫ����ʱ���ܵó�����ǡ���к͵Ľ��ۣ���Ϊǡ�÷�Ӧ����ϡ�������������ʹ��Һ��Ϊ��ɫ��
A������ϡ���ᷴӦ�����Ȼ������������������������ۣ�����������˵����Һ��û��ϡ���ᣬ���������⣻
B���μ���ɫʯ����Һ���������Һ������˵����Һ�Լ��ԣ�˵����Һ��û��ϡ���ᣬ���������⣻
C������̼������Һ���������ݣ�˵����Һ����ϡ���ᣬϡ�����̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ��������̼���������⡣��ѡC��

����Ŀ���ҹ��ຣ���ɼ�����Ȼ����Ʒ�ɱ�ʾΪaNa2CO3��bNaHCO3��cH2O��a��b��cΪ��������ȣ���С��ͬѧΪ�ⶨ����ɣ���ȡ����Ȼ����Ʒ16.6g��������ʵ�飺
��֪��1.̼���ƱȽ��ȶ������Ȳ��ֽ⣻
2. 2NaHCO3![]() Na2CO3 +CO2 ��+H2O
Na2CO3 +CO2 ��+H2O
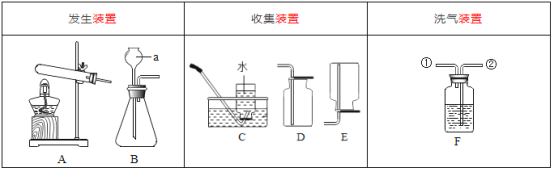
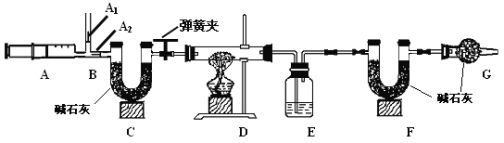
3.ͼ��B��Ϊ����������ע����ʱA1�رգ�A2������ע����ʱ��
A1��������A2�رա�
��һ��ʵ�鲽��
��1��ʵ��ʱ����װ��װ�ã�ʵ��ǰӦ�� ������ʵ�鲽���ǣ�
�� ��������ע����
�� ����E��F������
�� �رյ��ɼУ�����D���Թ�ֱ����Ӧ���ٽ���
�� ���ɼУ��ٴη�����������ע����
�� �ٴγ���E��F��������
����������̽����
��2�� E�е�ҩƷΪ ��E�������� ��ʵ������У�C�������� �� F�������� ��д�� Fװ������������Ӧ��һ����ѧ����ʽ ��
��3��ʵ�鲽���������ܷ�ߵ� �������������������������������в����IJ�����������õ�̼���������� ������ƫ��������ƫС��������Ӱ���������ò�������ע����ʱ������Ŀ���� ����û��Gװ�ã���̼�����Ƶ����� ������ƫ��������ƫС��������Ӱ��������
��4���±���ʵ���¼���ݣ�
��Ӧǰ | ��Ӧ�� |
E������Ϊ100.0g | E������Ϊ102.25g |
F������Ϊ50.0g | F������Ϊ51.1g |
�� �� ̼�����Ʒֽ����ɶ�����̼������Ϊ g
�� ̼�����Ƶ�����Ϊ g
�� ����Ȼ��Ļ�ѧʽ��a:b:c= ��