题目内容
【题目】某同学取8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,则该混合固体中金属元素的百分含量为
A. 70%B. 40%C. 30%D. 60%
【答案】D
【解析】
解:ZnO、Al2O3与稀盐酸反应的化学方程式为:ZnO+2HCl═ZnCl2+H2O,Al2O3+6HCl═2AlCl3+3H2O,根据金属活动性顺序表,铜不和稀盐酸反应;由于8gZnO、Al2O3、Cu的混合固体,与73g20%的稀盐酸混合后恰好完全反应,分析化学方程式可以知道氧化铝、氧化锌中的氧元素则转变为水中的氧元素,即混合物中氧元素的质量和水中氧元素的质量相等,由方程式可得盐酸与水的关系式为2HCl~H2O,设生成水中氧元素的质量为x,73g20%的稀盐酸中氯化氢的质量=73g×20%=14.6g,
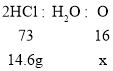
![]()
解得:x=3.2g
则该混合固体中金属元素的百分含量为![]() ×100%=60%。故选D。
×100%=60%。故选D。

练习册系列答案
相关题目