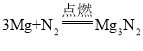题目内容
【题目】我国有悠久的茶历史。
(1)可用五色土烧制的紫砂壶泡茶,紫砂壶烧制的过程发生____________(填“物理变化”或“化学变化”)。
(2)泡茶常用80- 100°C水,闻到茶香是因为_____________(从分子角度回答)。
(3)从紫砂壶嘴倒出澄清透澈的茶水______________(填“是”或“不是”)纯净物,品茶有鲜味是因茶水中含有茶氨酸(C7 H14N2O3),茶氨酸中C、N元素的质量比为__________________。
(4) 制作鸡茶饭,用料:鸡胸肉、鸡蛋、小麦粉、粳米饭、食盐、干紫菜丝、绿茶末、酒等。上述用料主要提供蛋白质的是______,干紫菜丝富含人体所需的_______________元素;食盐调味并提供人体需要的无机盐,医用生理盐水是0.9%的氯化钠溶液存在的微粒有______________(填化学符号),500g生理盐水可提供人体所需的钠元素质量_______________(列式表示)。
(5)氮肥是重要的肥料,茶树种植常施铵态氮肥。下列物质是铵态氮肥的是____________(填标号)。请写出鉴别铵态氮肥的方法__________。
A .KNO3
B. CO (NH2)2
C. NH4NO3
D. CaHPO4
【答案】化学变化 分子在连续不断的运动 不是 3:1 鸡胸肉、鸡蛋 碘 Na+、Cl-、H2O ![]() C 取样,加入熟石灰后一起混合研磨,有刺激性气味的气体生成,则为铵态氮肥。
C 取样,加入熟石灰后一起混合研磨,有刺激性气味的气体生成,则为铵态氮肥。
【解析】
(1)紫砂壶烧制过程涉及某些燃料的燃烧,有新物质生成,所以发生了化学变化;
(2)从微观角度来看,人们能够闻到茶香是因为分子在连续不断的运动;
(3)茶水成分不止一种,属于混合物;茶氨酸中C、N元素的质量比=碳原子个数×碳原子相对原子质量:氮原子个数×氮原子相对原子质量=![]() ;
;
(4)含有蛋白质的食物主要包括肉、蛋、奶类以及豆类植物,所以提高蛋白质的为鸡蛋和鸡胸肉;紫菜中含有人体所需的碘元素,所以干紫菜丝富含碘元素;生理盐水中溶质为氯化钠,溶剂为水,氯化钠在水中会解离出Na+和CI-,水则是由水分子(H2O)构成,因此,生理盐水中存在的微粒主要有Na+、CI-和H2O;生理盐水可提供人体所需的钠元素质量,可先求出生理盐水中氯化钠的质量=![]() ,再根据.氯化钠中钠元素的质量分数求得钠元素质量,列式为
,再根据.氯化钠中钠元素的质量分数求得钠元素质量,列式为![]() ;
;
(5)根据题目信息,肥料中应该含有铵根离子:
A、KNO3含有硝酸根,选项A与题意不符;
B、CO (NH2)2尿素为氮肥,不含有铵根离子,选项B与题意不符;
C、NH4NO3中含有NH4+,故为铵态氮肥,选项C符合题意;
D、CaHPO4不含有氮元素,不属于氮肥,选项D与题意不符;故选C;
由于铵态氮肥内含有铵根离子,铵根离子与碱反应可以生成氨气,氨气为刺激性气味气体,可以将肥料与碱混合后,根据气体味道,判断是否为铵态氮肥,所以取样,加入熟石灰后一起混合研磨,有刺激性气味的气体生成,则为铵态氮肥。

【题目】(1)某化学兴趣小组的同学向无水乙醇中放入一小块金属钠,观察到有气泡产生。小组同学对这一现象产生了兴趣,进行了如下探究
(提出问题)无水乙醇和金属钠反应产生的气体是什么?
(查阅资料)I无水乙醇(CH3CH2OH)和金属钠反应生成乙醇钠CH3CH2ONa)和一种常见的可燃性气体;
Ⅱ浓硫酸具有较强的吸水性,可用作某些气体的干燥剂,比
Ⅲ白色的无水硫酸铜粉末遇水后会变成蓝色。
(猜想与假设)猜想一:CO;猜想二:CH4;猜想三:H2。兴趣小组的同学提出上述猜想的理论依据是_______________
(设计并实验)兴趣小组的同学分成甲、乙两组设计实验方案进行探究。
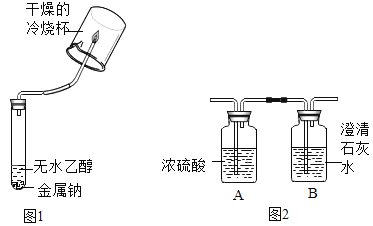
①甲组同学设计的实验方案如下:
实验操作 | 实验现象 | 实验结论 |
将反应产生的气体点燃在火焰上方罩一个干燥的冷烧杯 | 烧杯内壁有小液滴生成 | 猜想三成立 |
②乙组同学认为只完成上述实验猜想二也可能成立理由是 _________,并设计了如下实验进一步验证:将反应产生的气体点燃,燃烧产物依次通人A、B装置(如图2),测得A装置中质量增大,B装置中质量不变乙组的同学根据实验数据分析,证明猜想_________成立
(得出结论)无水乙醇与金属钠反应的化学方程式为_____________;该反应的基本反应类型是____________。
(实验反思)甲组同学受到乙组同学的启发认为只需要增加一个实验:再在火焰上方罩一个内壁蘸有澄清石灰水的烧杯,观察现象,就能使本组的实验方案更加完善。你认为此方案________ (选填“合理”或“不合理”)。
(拓展延伸)要确认该实验过程中所用的乙醇是无水乙醇的实验方法是____________。
(2)小明同学为了测定实验室中一瓶标签破损的硫酸的溶质质量分数,他取20g该硫酸于烧杯中,向其中加入10g锌粉(锌粉过量),完全反应后测得烧杯内物质的总质量为29.9g。该瓶硫酸的溶质质量分数是___________?
【题目】[观察与问题]镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件。
I.从生成物角度分析,进行探究
实验一:刮下镁条表面的黑色物质于试管中,加入足量的稀盐酸产生气体,把生成的气体通入澄清石灰水,观察到石灰水变浑浊。由此可知镁条变黑与空气中的_________有关,原因是_________。
II.从反应物角度分析,进行探究
[猜想与假设]在实验一的基础上猜想镁条变黑具体与空气中的哪些物质有关,甲、乙、丙、丁四位同学分别提出了如下猜想:
甲: CO2
乙: CO2 O2
丙: CO2 H2O
丁:_________。
[实验与探究]
实验二:通过控制与镁条接触的物质,利用如图所示装置(镁条长度为3 cm,试管容积为20 mL),分别进行下列4个实验,并持续观察10天。请将下表中实验操作补充完整。
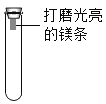
编号 | 主要实验操作 | 实验现象 |
① | 先收集满二氧化碳,再加入2ml浓硫酸 | 镁条始终无明显变化 |
② | 先集满体积比为1 : 1的二氧化碳和氧气的混合气体,再加 入__________ mL浓硫酸 | 镁条始终无明显变化 |
③ | 先收集满二氧化碳,再加入2mL蒸馏水 | 镁条始终无明显变化 |
④ | 先集满体积比为1 : 1的二氧化碳和氧气的混合气体,再加入2 mL蒸馏水 | 镁条第1天开始变黑至第10天全部变黑 |
[解释与结论]
(1)实验①和②中的浓硫酸的作用是___________。在这两个实验中____________(填“能”或“不能”)用烧碱代替浓硫酸,原因是_____________(用化学方程式表示)。
(2)实验③的目的__________。
(3)由上述实验可推知,镁条变黑的条件是________。
[反思与评价]
(4)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。