题目内容
【题目】为测定一瓶久置的烧碱中氢氧化钠的含量,某同学取25.0g样品,溶于水得到100g溶液,再加入100g足量稀硫酸。充分反应至不再产生气体,测得溶液质量为197.8g。请计算:
(1)反应产生二氧化碳的质量;
(2)样品中氢氧化钠的质量分数;
(3)最后所得溶液中钠元素的质量。
【答案】(1)2.2g;(2)78.8%;(3)13.6275g
【解析】
(1)根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量=100g+100g﹣197.8g=2.2g。
(2)设所取样品中含有Na2CO3的质量为x。
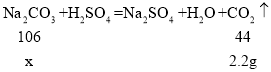
![]()
解之得:x=5.3g;
烧碱样品中NaOH的质量为:25.0g﹣5.3g=19.7g
样品中NaOH的质量分数=![]() =78.8%
=78.8%
(3)所得溶液中钠元素的质量=![]() 。
。

练习册系列答案
相关题目
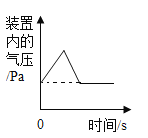
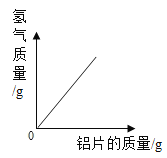
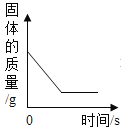
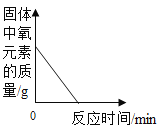
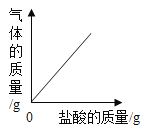
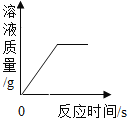
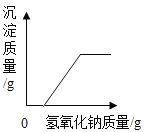
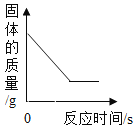
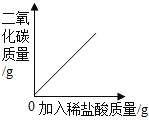
【题目】下列4个坐标图分别示意实验过程中某些量的变化,其中正确的是
|
|
|
|
A.向一定量石灰石中滴加稀盐酸 | B.在某一密闭装置内点燃红磷 | C.加热一定量高锰酸钾固体 | D.电解水生成氢气和氧气质量 |
A. AB. BC. CD. D