题目内容
【题目】新能源汽车的研发和使用是时代发展的需要。
(1)下列能源不属于新能源的是____________。(填字母序号)
A氢能 B核能 C石油 D风能
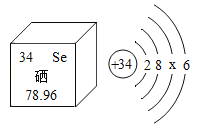
(2)锂电池可为新能源汽车提供动力,已知锂原子结构示意图 ![]() 下列结构示意图表示的粒子与锂原子的化学性质最为相似的是______(填字母)
下列结构示意图表示的粒子与锂原子的化学性质最为相似的是______(填字母)
A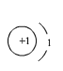 B
B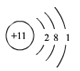 C
C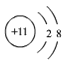 D
D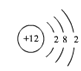
(3)新能源汽车除了节约化石能源外,其主要优点是______________。
【答案】C B 清洁环保、低能耗
【解析】
(1)新能源又称非常规能源,是指传统能源之外的各种能源形式。指刚开始开发利用或正在积极研究、有待推广的能源,如:太阳能、地热能、潮汐能、氢能和核能等。石油被人类早已大范围使用,且技术也十分成熟,不属于新能源,故选:C;
(2)在原子结构示意图中,小圆圈表示原子核,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。具有稳定结构的原子彼此化学性质相似,不是稳定结构的原子,最外层电子数相同的化学性质相似。已知锂原子结构示意图 ![]() ,下列结构示意图表示的粒子与锂原子的最外层电子数相同,化学性质最为相似的是B;
,下列结构示意图表示的粒子与锂原子的最外层电子数相同,化学性质最为相似的是B;
(3)新能源汽车除了节约化石能源外,因为新能源不产生污染物,热值高,其主要优点是清洁环保、低能耗。

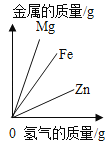
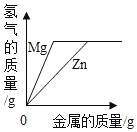
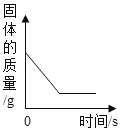
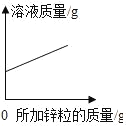
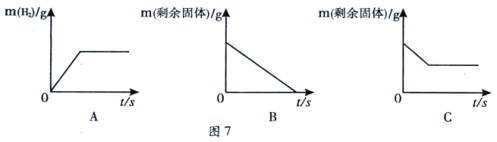
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D
【题目】某化学兴趣小组想要探究一包食品脱氧剂的成分,剪开包装袋,发现脱氧剂大部分为黑色固体,其中混有少量白色粉末。
【提出问题】脱氧剂的成分是什么?
【猜想与假设】经过查阅资料,小组同学提出猜想:
甲同学:可能有铁粉
乙同学:可能有炭粉,因为活性炭具有__________性,可以将空气中的氧气富集在脱氧剂周围。
【设计实验】小组同学根据两位同学的猜想设计了实验方案,请完成下表:
实验步骤 | 实验现象 | 实验结论 |
向脱氧剂中加入足量的_____ | 固体部分溶解,有气泡产生 | 甲、乙同学的猜想均成立 |
过滤,将滤渣与氧化铜混合加热 | ______________ |
【反思与评价】
(1)滤渣与氧化铜的反应需在高温条件下进行,从实验装置角度考虑,可以通过___的方法来提供高温。
(2)有同学提出,可以用一种简单的物理方法验证甲同学的猜想,请写出使用此方法的实
验操作及现象:___________________________。
(3)老师告诉同学们,脱氧剂的脱氧原理是利用铁与氧气、水反应生成氢氧化铁来吸收包
装袋中氧气,从而延长食品的保质期。该反应的化学方程式是____________________。
(4)小组同学又对脱氧剂中的白色粉末产生好奇,经查阅资料,白色粉末可能是硅藻土。硅藻土是一种填充剂,不溶于水,其作用在于吸附水分,为脱氧反应提供水分;并疏松配料,使氧气易于接触铁粉。如图是硅藻土用量与脱氧时间(h)的关系图,可知:
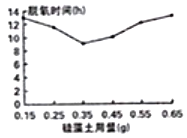
①硅藻土的最佳用量是__________g。
②硅藻土高于或低于最佳量时,脱氧速度会减慢。
请分别分析可能的原因____________________,________________________。
③脱氧剂的脱氧速度还有可能受哪些因素影响?
请写出一条并说明理由:_______________________________。
【题目】下面有关氢氧化钠溶液的配制,请完成:
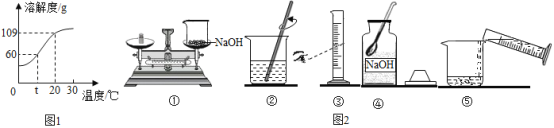
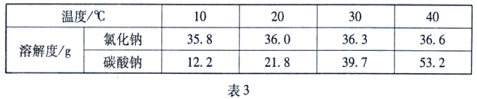
(1)氢氧化钠的溶解度曲线如1图,则:
①t℃时氢氧化钠溶解度是_____;
②20℃时,小惠向100g的水中加入120g氢氧化钠,发现溶液的温度_____(填“上升”“下降”或“不变”),氢氧化钠全部溶解。过一段时间恢复到20℃时,又有部分氢氧化钠晶体析出,所形成的溶液是_____溶液(填“饱和”或“不饱和”),析出的晶体质量是_____g;
③配制100g 10%的氢氧化钠溶液,所需水的质量是_____g。
(2)如图2是她配置氢氧化钠溶液的实验操作示意图。
①实验操作示意图中的操作错误的是_____(填编号);
②纠错后用上述图示的序号表示配置溶液的操作顺序:_____。
(3)某研究小组对自动充气气球(示意图如下图1)进行下列探究。
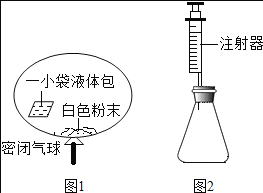
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
①为检验气体是二氧化碳,可选用_____(填试剂名称)。
探究一:液体包内溶液酸碱性的探究
②室温时,用pH试纸测得溶液的pH=3,则该溶液呈_____性。
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
[设计并进行实验]
③将少量白色粉末放入足量水中搅拌,固体全部溶解,说明甲同学的猜想_____(填“正确”或“不正确”)、
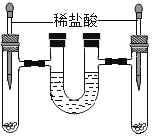
④室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
a | 碳酸氢钠 | 0.10 | V1 |
b | 碳酸钠 | x | V2 |
c | 白色粉末 | 0.10 | V1 |
实验a的化学方程式为_____;表中x=_____;V1_____V2(填“>”、“<”或“=”)、
[分析并得出结论]
⑤白色粉末是_____。