题目内容
【题目】人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.
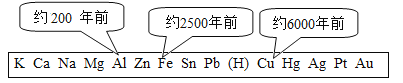
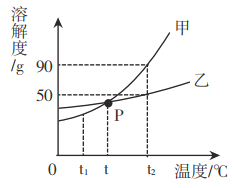
(1)上图表示金属活动性顺序中铝、铁和铜被人类大规模开发利用的大致年限,根据图中数据和相关化学知识,你认为金属大规模开发利用的先后顺序与下列因素无关_____
A 金属冶炼的难易程度
B 地壳中金属元素的含量
C 金属的活动性
(2)请用一个化学方程式说明铁的金属活动性比铜强_____.
(3)工业上电解氧化铝制取金属铝的化学方程式是:2Al2O3![]() 4Al+3O2↑,电解51t的氧化铝最多可生产多少吨铝?
4Al+3O2↑,电解51t的氧化铝最多可生产多少吨铝?
(4)实际生产中氧化铝可从铝土矿提炼获得.要生产相同质量的铝,所需铝土矿的质量应_(填“大于”、“小于”或“等于”)氧化铝质量_____.
【答案】B Fe+CuSO4=FeSO4+Cu 27t 大于
【解析】
(1)金属的活动性越强,即金属越活泼,越难冶炼,人类大规模开发利用的时间越晚,因此金属大规模开发利用的先后顺序与地壳中金属元素的含量无关,故选B;
(2)铁比铜活泼,能和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;
(3)设生成铝的质量为x,

![]()
x=27t,
(4)铝土矿中含有氧化铝和杂质,要生产相同质量的铝,所需铝土矿的质量应大于氧化铝质量。

【题目】氯酸钾在工业上用于制造焰火、漂白剂等,在实验室可用于制造氧气。工业上利用石灰浆制备氯酸钾的流程是:

(1)写出实验室用氯酸钾制取氧气的化学方程式____________________。
(2)在实验室里,“操作a”中需要用到玻璃棒,其作用是__________。
(3)“反应1”的化学反应方程式为:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6X,Ca(ClO3)2的名称是__________,X的化学式为__________。
(4)下表是有关物质常温下的溶解度。
物质 | KCl | CaCl2 | KClO3 | Ca(ClO3)2 |
溶解度/g | 34.2 | 74.5 | 7.3 | 209.0 |
“反应2”为复分解反应,参看表中溶解度,写出该反应的化学方程式__________。
(5)上述石灰浆可由电石(CaC2)与水反应制得。现有某电石渣,其中含氢氧化钙92.5%,用该电石渣处理含硫酸49Kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),需要电石渣的质量是__________kg。
【题目】下列实验的操作、现象、结论均正确的是![]()
实验操作 | 现象 | 结论 | |
A | 向收集满CO2的软塑料瓶中加入约三分之一体积的NaCl溶液,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与NaCl反应 |
B | 用玻璃棒取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出待测液的pH | pH试纸显示pH=1对应的红色 | 待测液显酸性 |
C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯。 | 烧杯内壁有无色液滴产生 | 该气体一定是CH4 |
A.AB.BC.CD.D
【题目】某班学生在老师指导下探究铁与水蒸气的反应。
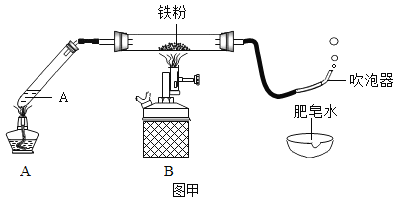
(1)按图甲装好药品、连好装置(夹持仪器已略去)。其中A装置的作用是______。
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。该气体燃烧的化学方程式是_______。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
(查阅资料)铁有三种氧化物,FeO(黑色、无磁性)、Fe2O3(红棕色、无磁性)、Fe3O4(黑色、有磁性);铁的三种氧化物都不与硫酸铜溶液反应。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
①取上述黑色固体少许,装入试管,加入足量硫酸铜溶液 | 有红色固体出现 | 黑色固体中一定含有______ |
②过滤第①步的产物,将所得固体干燥,用磁铁接触该固体 | 固体可以被磁铁吸起 | 黑色固体中一定含有_______ |
(探究结论)铁与水蒸气发生置换反应,有关的化学方程式是_______。
(拓展创新)同学们利用微型仪器“长柄V形玻璃管”改进了图甲装置,设计出图乙装置,并分别选用湿棉布、湿粉笔、芦荟叶、氢氧化铜等作为供水剂,实验都获得成功。
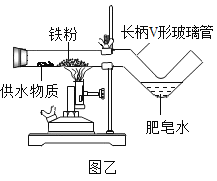
①甲、乙装置相比,乙装置有很多优点,请你写出一条。_____。
②用化学方程式解释氢氧化铜供水的原理:______。
(4)某磁铁矿石含Fe3O480%。若冶炼336t铁,则理论上需该铁矿石多少吨?_____