题目内容
【题目】现有硫酸镁和硫酸钠的混合物12.8g,全部溶于50g水中,加入一定质量的氢氧化钠溶液,恰好完全反应后,过滤,得到5.8g沉淀,所得溶液中溶质的质量分数为15%(不考虑过滤过程中物质质量的损失)。计算:
(1)原混合物中硫酸钠的质量_______。
(2)所加氢氧化钠溶液中溶质的质量分数_______(计算结果精确到0.1%)
【答案】0.8g 18.6%
【解析】
(1)得到沉淀质量为5.8g,即反应后生成氢氧化镁的质量为5.8g;
设混合物中硫酸镁的质量为x,氢氧化钠溶质质量为z,沈城的硫酸钠质量为y。

![]() =
=![]() =
=![]() =
=![]()
解之得:x=12g,z=8g,y=14.2g;
混合物中硫酸钠的质量为12.8g-12=0.8g;
(2)反应后所得硫酸钠溶液质量为![]() =100g
=100g
所加氢氧化钠溶液的质量为:100g+5.8g-50g-12.8g=43g
氢氧化钠溶液中溶质质量分数=![]() ×100%≈18.6%;
×100%≈18.6%;
答:混合物中硫酸钠的质量为0.8g;
氢氧化钠溶液中溶质的质量分数为18.6%。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】下列图像能正确反映实验过程中相应量变化的是
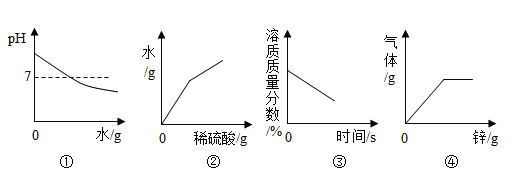
A.图①:向氢氧化钠溶液中加水
B.图②:向氢氧化钡溶液中加足量稀硫酸
C.图③:将接近饱和的硝酸钾溶液缓慢降温
D.图④:向一定量的稀硫酸中加入过量的锌
【题目】某氯化钙中含有碳酸钙杂质,称取研细的该样品12.4g放入锥形瓶中,加入32.6g水,充分振荡形成悬浊液,再向锥形瓶中逐滴滴加盐酸使其充分反应至无气泡产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如表所示.
加入盐酸的质量/g | 0 | 37.5 |
锥形瓶中物质的质量/g | 45 | 80.3 |
(有关反应的化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑)
(1)反应产生二氧化碳的质量为 g。
(2)求样品中碳酸钙的质量分数(写出计算过程,精确到0.1%)。