题目内容
【题目】氯酸钾在工业上用于制造焰火、漂白剂等,在实验室可用于制造氧气。工业上利用石灰浆制备氯酸钾的流程是:

(1)写出实验室用氯酸钾制取氧气的化学方程式____________________。
(2)在实验室里,“操作a”中需要用到玻璃棒,其作用是__________。
(3)“反应1”的化学反应方程式为:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6X,Ca(ClO3)2的名称是__________,X的化学式为__________。
(4)下表是有关物质常温下的溶解度。
物质 | KCl | CaCl2 | KClO3 | Ca(ClO3)2 |
溶解度/g | 34.2 | 74.5 | 7.3 | 209.0 |
“反应2”为复分解反应,参看表中溶解度,写出该反应的化学方程式__________。
(5)上述石灰浆可由电石(CaC2)与水反应制得。现有某电石渣,其中含氢氧化钙92.5%,用该电石渣处理含硫酸49Kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),需要电石渣的质量是__________kg。
【答案】2KClO3![]() 2KCl+3O2↑ 引流 氯酸钙 H2O Ca(ClO3)2+2KCl=2KClO3↓+CaCl2 40
2KCl+3O2↑ 引流 氯酸钙 H2O Ca(ClO3)2+2KCl=2KClO3↓+CaCl2 40
【解析】
(1)实验室用氯酸钾制取氧气,是氯酸钾和二氧化锰在加热条件下生成氯化钾和氧气,对应的化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(2)在实验室里,“操作a”即为过滤,过滤中需要用到玻璃棒,其作用是引流;
(3)“反应1”的化学反应方程式为:6Ca(OH)2+6Cl2═Ca(ClO3)2+5CaCl2+6X,Ca(ClO3)2的中酸根为氯酸跟,所以化合物对应的名称是氯酸钙,反应中,反应前钙原子6个,氧原子12个,氢原子12个,氯原子12个,反应后现有钙原子6个,氧原子6个,氯原子12个,缺少12个氢原子和6个氧原子,这些微粒分布在6个X分子中,所以X的化学式为H2O;
(4)“反应2”为复分解反应,是氯酸钙和氯化钾反应,根据给出的溶解度可知,氯酸钾溶解度最小,所以生成物为氯酸钾和氯化钙,对应的化学方程式 Ca(ClO3)2+2KCl=2KClO3↓+CaCl2;
(5)设需要电石渣的质量是x,

![]()
x=40kg。

【题目】酸、碱、盐在生产生活中具有广泛的用途。化学实验室中有失去标签的四瓶无色溶液:稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液,现将其任意编号为A、B、C、D.然后两两组合进行实验,其中部分现象如下表,请回答:
实验 | A+B | A+C | B+C | B+D |
现象 | 溶液变红 | 溶液变红 | 产生沉淀 | 产生气体 |
(1)配酞试液是____________(填编号);
(2)B与C反应的化学方程式为____________________。
(3)写出D的一种用途:____________________。
【题目】化学小组同学在课外读物中看到:“加热时,过氧化钠(Na2O2)能与木炭发生化学反应”。他们决定探究Na2O2与木炭反应的产物。
(猜想与假设)木炭与Na2O2反应可能生成4种物质:CO、CO2、Na2O和Na2CO3。
(查阅资料)
① 碱性的碳酸钠溶液与中性的CaCl2溶液能发生复分解反应。
② 氧化钠(Na2O)是白色固体,与H2O反应生成NaOH。
③ 氯化钯(PdCl2)溶液能检验CO的存在,向溶液中通入CO,产生黑色沉淀。
(进行实验)同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)。
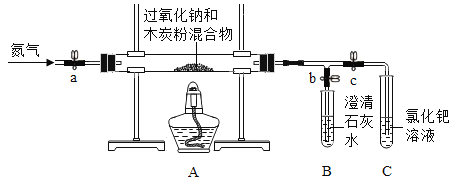
序号 | 实验操作 | 主要实验现象 | 实验结论 |
① | 检查装置气密性。向玻璃管中加入过氧化钠和过量木炭粉的混合物。打开弹簧夹a、b,关闭c,从装置左端通一段时间N2。 | A中无明显变化,B中有大量气泡冒出。 | 气密性良好。 |
② | 关闭a,点燃酒精灯。 | 试管中发生剧烈反应,产生火花,________________。 | 产物中没有CO2。 |
③ | 打开c,关闭b。 | C中PdCl2溶液没有明显变化。 | ___________________。 |
④ | 打开a,继续通N2,停止加热,待冷却后停止通N2。取出少量反应后固体于试管中,加入足量稀盐酸,迅速用带导管的橡胶塞塞紧试管口,导管另一端通入石灰水中。 | _____________________。 | 产物中有Na2CO3。 |
(解释与结论)
(1)检验第4种物质存在的实验方案:取出少量反应后固体于试管中,_______________,则第4种物质存在。
(2)Na2O2与木炭反应的化学方程式为_________________________________。
(反思与评价)实验操作④中若不通入N2,可能造成的结果是________________________。
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(提出问题)黑色颗粒和白色物质是什么?
(进行猜想)甲认为黑色颗粒是________,白色物质可能是Na2O或________或________,乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是____________________________。
(查阅资料)氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O===2NaOH
(实验探究)甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色醉酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCI2溶液 | 出现白色沉淀 | 白色物质是_____ |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(反思评价)丙同学认为方案1得到的结论不正确,其理由是________________。
(得出结论)钠在二氧化碳中燃烧的化学方程式为___________________________。