题目内容
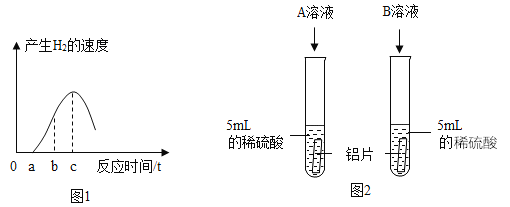
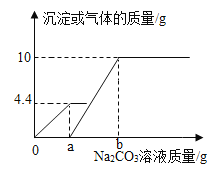
【题目】向一定质量CaCl2和HCl的混合溶液中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。
计算混合溶液中CaC12的质量。
【答案】11.1g
【解析】
氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,方程式为:Na2CO3+CaCl2=2NaCl+CaCO3↓
盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
加入碳酸钠后,应该先和盐酸反应,再与氯化钙反应。若假设先和氯化钙反应,生成的碳酸钙沉淀会继续和盐酸反应。
解:根据图示可以得出反应生成CaCO3的质量为10g,反应生成的二氧化碳气体的质量为4.4g。
设混合溶液中CaCl2的质量为![]() 。
。
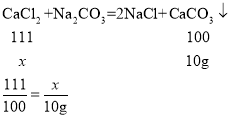
解得![]() =11.1g
=11.1g
答:混合溶液中CaCl2的质量为11.1g。

【题目】建立宏观、微观和符号之间的联系是化学学科的特点。
(1)将密封良好的方便面从平原带到高原时,包装袋会鼓起,这是因为_____。(填序号)
A 气体分子个数增多了
B 气体分子之间间隔变大了
C 气体分子之间间隔变小了
D 气体分子的体积变大了
(2)金属钠、镁化学性质有区别的原因是_____。
(3)A、B、C、D分别表示4种物质,部分物质的分子的微观示意图如下图所示。
物质 | B | C | D | 图例 |
微观示意图 |
|
|
|
|
A和B在一定条件下可发生如下反应A+2B=C+2D,则A、B、C、D中属于单质的是_____(填字母序号),A的化学式为_____。
【题目】关于下列事实的解释不正确的是( )
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 分子之间有间隔 |
B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+ , 也存在不同的SO42-、Cl-离子 |
C | 酒精溶液不导电 | 溶液中没有自由移动的带电粒子 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵与熟石灰发生中和反应 |
A.A B.B C.C D.D