题目内容
【题目】用科学方法认识和改造物质。请你参与探究并填空:按照科学认识的过程,科学方法主要蕴含在两个阶段:一是感性认识阶段,主要是为了获得证据,如观察、预测、实验等;二是理性认识(理性思维)阶段,主要是为了形成科学认识,如科学抽象、科学假说,像比较与对比、归纳与演绎等。在前一阶段的学习中,我们通过实验、观察等手段验证了很多化学反应的发生,运用了“归纳、演绎;比较、对比”等科学的一般方法认识了几种典型的酸、碱、盐。请你运用以上方法认识硫酸铜。
(1)用归纳/演绎的方法认识硫酸铜的化学性质已知下列反应:
H2SO4+BaCl2═BaSO4↓+2HClNa2SO4+BaCl2=BaSO4↓+2NaCl
MgSO4+BaCl2═BaSO4↓+MgCl2K2SO4+BaCl2=BaSO4↓+2KCl
①从微观分析这组反应能够发生的原因是_____。
②由①中得到的规律可以推论“硫酸铜溶液也能跟氯化钡溶液反应”,运用的是_____的方法.
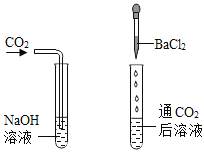
(2)用实验的方法认识硫酸铜的化学性质首先验证(1)②中“硫酸铜溶液也能跟氯化钡溶液反应”的推论,需进行实验是:
实验操作 | 实验现象 | 结论 |
取少量硫酸铜溶液于A试管中,然后再滴加氯化钡溶液 | _____ | 结论:硫酸铜溶液能跟氯化钡溶液反应 |
②用实验的方法认识硫酸铜的其他性质
实验操作 | 实验现象 | 结论 |
取少量硫酸铜溶液于B试管中,然后再滴加2﹣3滴紫色石蕊试液,振荡 | 石蕊试液变红 | 结论:硫酸铜溶液显_____ |
取少量硫酸铜溶液于C试管中,然后再滴加氢氧化钠溶液 | _____ | 结论:_____ |
(3)用重要的学科实验方法——“化学转化法”改造物质人类利用化学变化,创造出我们所需要的物质,极大地促进了人类社会的发展。我们的祖先很早就掌握了多种炼铜工艺。
◆火法炼铜:将孔雀石(主要成分是Cu2(OH)2CO3)和木炭一起加热可以得到红色的金属铜,请写出上述反应的化学方程式:①_____。②_____。(友情提示:孔雀石受热易分解,得到氧化铜、二氧化碳和水;在加热的条件下木炭和氧化铜反应得到铜和二氧化碳。)
◆湿法炼铜:将天然铜的化合物进行湿法炼铜,先用硫酸与氧化铜反应,再用铁置换出铜。“曾青得铁则化为铜”,“曾青”指可溶性铜盐,即铜盐遇到铁,就有铜生成。请写出上述反应的化学方程式:①_____。②_____。(友情提示:先用硫酸与氧化铜反应得到可溶性铜盐;铜盐遇到铁就有铜生成。)
【答案】钡离子能与硫酸根离子结合产生硫酸钡沉淀 演绎 有白色沉淀产生 酸性 有蓝色沉淀产生 硫酸铜能与氢氧化钠反应 Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑ C+2CuO
2CuO+H2O+CO2↑ C+2CuO![]() 2Cu+CO2↑ CuO+H2SO4═CuSO4+H2O Fe+CuSO4=FeSO4+Cu
2Cu+CO2↑ CuO+H2SO4═CuSO4+H2O Fe+CuSO4=FeSO4+Cu
【解析】
(1)①根据反应的四个化学方程式可以看出,都有硫酸钡沉淀产生,故从微观的角度看反应能够发生的原因是钡离子能与硫酸根离子结合产生硫酸钡沉淀,故填:钡离子能与硫酸根离子结合产生硫酸钡沉淀.
②由①中得到的规律可以推论:“硫酸铜溶液也能跟氯化钡溶液反应”,这是运用的演绎的方法,故填:演绎.
(2)硫酸铜与氯化钡反应产生硫酸钡白色沉淀,故填:有白色沉淀产生;
石蕊试液变红,说明硫酸铜溶液呈酸性;氢氧化钠能与硫酸铜反应产生蓝色沉淀,故填:酸性;有蓝色沉淀产生;硫酸铜能与氢氧化钠反应;
(3)将孔雀石【主要成分是Cu2(OH)2CO3】和木炭一起加热可以得到红色的金属铜.是因为碱式碳酸铜能受热分解生成氧化铜、二氧化碳和水,木炭与生成的氧化铜高温反应生成铜和二氧化碳,故填:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑;C+2CuO
2CuO+H2O+CO2↑;C+2CuO![]() 2Cu+CO2↑;
2Cu+CO2↑;
用硫酸与氧化铜反应生成硫酸铜和水;铁与硫酸铜反应生成硫酸亚铁和铜,故填:CuO+H2SO4═CuSO4+H2O;Fe+CuSO4=FeSO4+Cu.

【题目】现有25 g石灰石样品,请按下面要求计算:
(1)25 g样品与足量的稀盐酸反应放出8.8 gCO2(杂质不溶于酸,且不与酸反应),请计算该样品的纯度(CaCO3的质量分数)是多少________?
(2)若将一定质量的该石灰石样品高温煅烧,有关物质质量随反应时间的变化如表所示:
时间/min | t1 | t2 | t3 | t4 | t5 |
CO2质量/g | 2.2 | 4.4 | 6.6 | 8.8 | 8.8 |
剩余固体质量/g | 22.8 | 20.6 | m | 16.2 | 16.2 |
则m=_____,t3时剩余固体中除杂质外含有的物质是____(填化学式)。
【题目】化学科学十分重视实证和理性思维。在课堂学习中,通过选用典型物质进行典型实验,采用实证法进行有关物质化学性质的研究。运用“比较归纳”的方法得出一些科学结论。
◆氧气的化学性质:氧气的化学性质比较活泼,能与很多物质发生反应。图中所示的是探究氧气化学性质的实验。据图回答问题
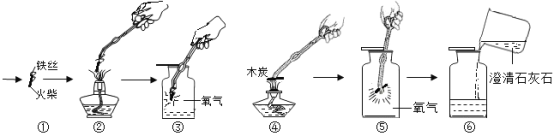
(1)图③中的现象:铁丝在纯氧气中剧烈燃烧,火星四射,放出大量的热,生成黑色固体。铁丝在空气中不能燃烧。木炭在图⑤中燃烧与木炭在图④中燃烧剧烈程度_____(选填“不同”或“相同”)。图⑥的实验目的是_____。
(2)根据上述木炭和铁丝燃烧的实验,你能归纳出物质燃烧的剧烈程度与_____有关。与燃烧一样,任何化学反应都需要在一定条件下进行。因此,通过控制反应条件,可以促进或抑制化学反应,使之满足人们的需要。请举一个生活中控制化学反应速率的具体实例:_____。
◆二氧化碳的化学性质:二氧化碳在通常情况下不能燃烧,也不支持燃烧;能够与水、碱溶液等物质发生反应。
(1)在学习酸的化学性质之前,小聪曾用紫色干燥的石蕊小花做了下图所示的探究实验,得出“二氧化碳与水反应生成酸”的结论,各实验的目的或结论如下表所示:
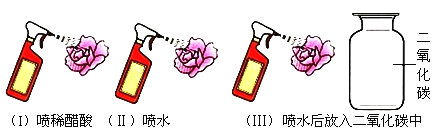
实验序号 | I | II | Ⅲ |
实验现象 | 紫色石蕊小花变红色 | 紫色石蕊小花不变色 | 紫色石蕊小花变红色 |
实验目的和结论 | 证明酸溶液能使紫色石蕊变红色 | 证明水不能使紫色石蕊变红色 | 证明二氧化碳与水反应生成酸使紫色石蕊变红色 |
小明同学对小聪同学的实验方案提出了质疑,他认为上述实验还不足以证明“二氧化碳和水反应生成了酸”,其理由是_____。两位同学讨论后补充做了一个实验,从而证明了“二氧化碳和水反应生成了酸”。补充实验的操作方法和现象分别是_____和_____。
(2)化学课上,老师将二氧化碳分别通入澄清石灰水和氢氧化钠溶液中,我们观察到前者有明显现象,后者无明显现象。为了探究二氧化碳和氢氧化钠是否确实发生了化学反应,同学们设计了下列实验装置(所有装置的气密性良好),试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。
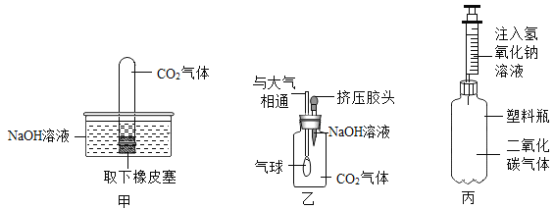
①如图所示,甲的实验现象:“在水下取出试管口的橡胶塞,试管内液面上升”;乙的实验现象:“气球慢慢胀大”;丙的实验现象:“软塑料瓶变瘪”。小智同学认为上述实验是可行的,其共同原理是氢氧化钠溶液与二氧化碳气体反应,使容器内压_____大气压(选填“大于”或“小于”)小慧同学提出了质疑,她认为上述实验还不足以证明二氧化碳与氢氧化钠确实发生了反应,其理由是二氧化碳能溶于水且与水反应。小慧思考后,对比甲实验装置又补充了一个对比实验,使实验方案更完善。小慧的补充实验中改变的因素是:将甲实验中的_____换成_____。
②小慧同学认为还可利用与上述实验不同的原理,设计如下实验方案,我们来帮她完成:
实验步骤和方法 | 实验现象 | 实验结论 | |
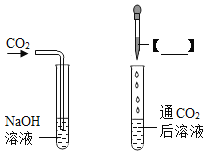
小慧第一方案 |
| _____ | 二氧化碳和氢氧化钠确实发生了化学反应 |
小慧第二方案 |
_____(短线上文字说明,不要再选用盐) | _____ |
(探究收获)通过上述对比实验的探究,同学们总结出对于无明显现象的化学反应,要判断反应的发生,可以通过改变实验装置,创设新的情境来观察到明显的反应现象判断反应的发生;也可以_____的存在来判断反应的发生。