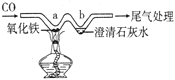
题目内容
【题目】根据如图信息回答问题:

(1)硫的相对原子质量是_____
(2)图1所示的粒子结构示意图表示的是_____(填“阴离子”或“阳离子”)
(3)硫原子在化学反应中容易_____(填“得到”或“失去”)电子
(4)写出钠元素于硫元素组成化合物的化学式并标出硫元素的化合价_____。
【答案】32.06 阳离子 得到 ![]()
【解析】
原子得到电子变成阴离子,失去电子变成阳离子;最外层电子数小于4的原子在反应中容易失去电子,大于4的在反应中容易得到电子;元素的化合价应该标在元素符号正上方。
(1)硫的相对原子质量是32.06。
(2)图1所示的粒子结构示意图表示的是钠原子失去1个电子后形成的钠离子,钠离子带正电荷,属于阳离子。
(3)硫原子最外层电子数是6,在化学反应中容易得到电子。
(4)钠原子在反应中容易失去1个电子,带上1个单位正电荷,化合价表现为+1,硫原子在反应中容易得到2个电子,带上2个单位负电荷,化合价表现为﹣2,钠元素于硫元素组成化合物的化学式及其硫元素化合价可以表示为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:氧化铜[CuO]能否起到类似MnO2的催化剂作用呢?于是进行了以下探究。
(猜想)
Ⅰ、CuO不是催化剂、也不参与反应,反应前后质量和化学性质都不变;
Ⅱ、CuO参与反应产生O2,反应前后质量和化学性质都发生了改变;
Ⅲ、CuO是反应的催化剂,反应前后_____。
(实验)用天平称量0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如下实验:
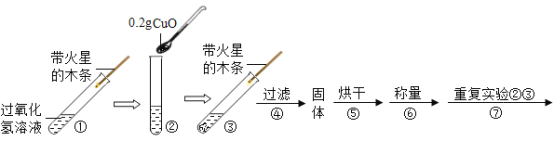
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_____,带火星的木条复燃。 | _____ | 溶液中有气泡放出,_____ | 猜想Ⅰ、Ⅱ不成立; 猜想Ⅲ成立。 |
(2)过氧化氢能被CuO催化分解放出O2的反应式为_____。
(实验拓展):
(3)某同学想比较二氧化锰和氧化铜对过氧化氢分解的催化效果,他需要对某些变量进行控制,其中包括有:_____。(至少三点)
【题目】生活中我们经常发现存放的铁钉会生锈。

(1)小牛和小明通过如图所示实验对铁制品生锈的条件进行探究。通过观察和试管B中加入植物油的目的是___________________。我得出铁生锈的条件是_______________。
(2)在实验室用稀盐酸除铁锈的实验中,小牛认为盐酸中含有H2O、H+、Cl―三种粒子,为了探究稀盐酸中哪种粒子能使铁锈溶解,他进行了如下实验,我能帮他完成。
实验步骤 | 实验现象 | 实验结论 | 设计实验的目的 |
向装有锈铁钉的试管中加入足量NaCl溶液,振荡 | 铁锈不溶解 | _________ | _________ |
小明认为还需要补做一个“向装有锈铁钉的试管中加入水”的对比实验,我认为这个实验是多余的,理由是_____________。小明在做铁钉除锈实验时,由于忘了及时从稀盐酸中取出已除掉铁锈的铁钉,过了一段时间后,他发现铁钉表面居然出现了黑色物质。通过分析我认为铁钉表面的黑色物质可能是_____________。
(3)为了探究铁锈除掉后溶液的组成,小牛将生锈的铁钉放入一支试管中,加入一定量的稀盐酸,待铁钉表面的铁锈恰好溶解完时,迅速取出铁钉,再进行以下实验。
实验步骤 | 实验现象 | 实验结论 |
向取出铁钉的溶液中加入过量的铁粉 | _________ | _________ |
我能写出(3)中的一个化学方程式_________
(4)通过以上探究,我获得的启示是_____________。
【题目】用科学方法认识和改造物质。请你参与探究并填空:按照科学认识的过程,科学方法主要蕴含在两个阶段:一是感性认识阶段,主要是为了获得证据,如观察、预测、实验等;二是理性认识(理性思维)阶段,主要是为了形成科学认识,如科学抽象、科学假说,像比较与对比、归纳与演绎等。在前一阶段的学习中,我们通过实验、观察等手段验证了很多化学反应的发生,运用了“归纳、演绎;比较、对比”等科学的一般方法认识了几种典型的酸、碱、盐。请你运用以上方法认识硫酸铜。
(1)用归纳/演绎的方法认识硫酸铜的化学性质已知下列反应:
H2SO4+BaCl2═BaSO4↓+2HClNa2SO4+BaCl2=BaSO4↓+2NaCl
MgSO4+BaCl2═BaSO4↓+MgCl2K2SO4+BaCl2=BaSO4↓+2KCl
①从微观分析这组反应能够发生的原因是_____。
②由①中得到的规律可以推论“硫酸铜溶液也能跟氯化钡溶液反应”,运用的是_____的方法.
(2)用实验的方法认识硫酸铜的化学性质首先验证(1)②中“硫酸铜溶液也能跟氯化钡溶液反应”的推论,需进行实验是:
实验操作 | 实验现象 | 结论 |
取少量硫酸铜溶液于A试管中,然后再滴加氯化钡溶液 | _____ | 结论:硫酸铜溶液能跟氯化钡溶液反应 |
②用实验的方法认识硫酸铜的其他性质
实验操作 | 实验现象 | 结论 |
取少量硫酸铜溶液于B试管中,然后再滴加2﹣3滴紫色石蕊试液,振荡 | 石蕊试液变红 | 结论:硫酸铜溶液显_____ |
取少量硫酸铜溶液于C试管中,然后再滴加氢氧化钠溶液 | _____ | 结论:_____ |
(3)用重要的学科实验方法——“化学转化法”改造物质人类利用化学变化,创造出我们所需要的物质,极大地促进了人类社会的发展。我们的祖先很早就掌握了多种炼铜工艺。
◆火法炼铜:将孔雀石(主要成分是Cu2(OH)2CO3)和木炭一起加热可以得到红色的金属铜,请写出上述反应的化学方程式:①_____。②_____。(友情提示:孔雀石受热易分解,得到氧化铜、二氧化碳和水;在加热的条件下木炭和氧化铜反应得到铜和二氧化碳。)
◆湿法炼铜:将天然铜的化合物进行湿法炼铜,先用硫酸与氧化铜反应,再用铁置换出铜。“曾青得铁则化为铜”,“曾青”指可溶性铜盐,即铜盐遇到铁,就有铜生成。请写出上述反应的化学方程式:①_____。②_____。(友情提示:先用硫酸与氧化铜反应得到可溶性铜盐;铜盐遇到铁就有铜生成。)