题目内容
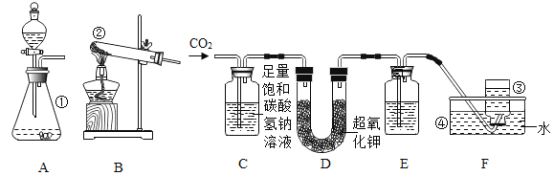
【题目】根据如图所示的实验回答问题:
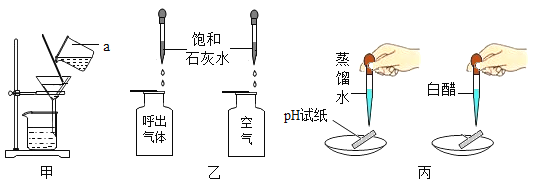
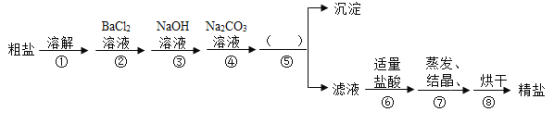
(1)甲实验进行粗盐提纯实验时,过滤的目的是______________。
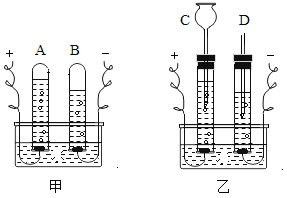
(2)乙实验验证人体呼出气体中二氧化碳含量比空气中多时,除了要检验两种气体样品的体积相同外,还要控制____________相同。
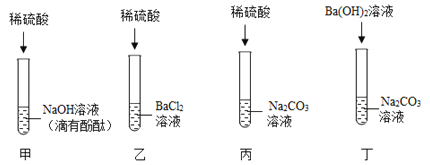
(3)丙实验用pH试纸测定液体的酸碱度时,测得蒸馏水的pH应为____________;测定白醋的pH时,先用蒸馏水润湿试纸则测得结果与实际值相比____________。(选择“偏大”、“偏小”或“相等”)
【答案】除去粗盐中难溶性杂质 石灰水的滴数或体积 7 偏大
【解析】
(1)过滤可实现固液分离,故过滤的目的是:除去粗盐中难溶性杂质;
(2)根据控制变量法,本实验是验证人体呼出气体中二氧化碳含量比空气中多,除了两种气体不同,其它因素都应相同,如要检验两种气体样品的体积相同,还要控制石灰水的滴数或体积相同;
(3)蒸馏水显中性,pH=7;
用蒸馏水润湿试纸,会稀释白醋的浓度,从而使测得的pH偏大。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】将一定量的苯(C6H6)和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水和一种未知物 X;测得反应前后物质的质量如下表:
物质 | 苯 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 3.9 | 9.6 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 6.6 | 2.7 | m |
下列判断正确的是( )
A.表中 m 的值为 13.5
B.物质 X 可能是该反应的催化剂
C.物质 X 能在氧气中燃烧
D.物质 X 中一定含有氢元素
【题目】下表是 20℃时部分物质的溶解度数据。
物质 | Ca(OH)2 | NaOH | CaCO3 | Ca(HCO3)2 | Na2CO3 | NaHCO3 |
溶解度/g | 0.16 | 109 | 0.0065 | 16.6 | 21.8 | 9.6 |
(1)配制溶液:配制 50g11%氢氧化钠溶液的基本步骤是:计算—称取氢氧化钠固体—量取水—溶解—装瓶贴标签。 用托盘天平称取氢氧化钠固体的质量_________ g。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向稀氢氧化钠溶液中通入 CO2,先生成 Na2CO3,继续通入 CO2,Na2CO3 会转化为 NaHCO3,已知后者为化合反应,请写出该化合反应的化学方程式:_________。 若向 20℃时饱和 Na2CO3 溶液中通入过量的 CO2,可观察到的现象是_________。
②结合表格中的有关数据,若以 20℃时,100g 饱和溶液吸收 CO2 的质量最大为依据,则除去 CO 气体中的 CO2 杂质,应选择_________溶液(填化学式),欲检验CO2气体的存在,则应选择_________溶液(填化学式)。
③将 2.2g CO2 通入 47.8g 一定浓度的 NaOH溶液中充分反应后(反应过程中没有CO2 逸出,水也没有蒸发),溶液中的溶质仅有 Na2CO3和 NaHCO3 两种物质(NaHCO3 在水中电离成 Na+和 HCO3-),则此时溶液中碳元素的质量分数为__________,在此反应过程中,你认为钠离子的个数_________发生变化?(填写: 有或者没有)
(3)电导率传感器可辅助探究复分解反应的实质。相同条件下,离子浓度越大,电导率越大,溶液导电性越强。将含有酚酞的 Ba(OH)2 溶液平均分成两份置于两个烧杯中 并插入电导率传感器,往其中一份滴加稀硫酸,往另一份滴加硫酸钠溶液,滴加过程中,这两份溶液的滴加速率始终相同,测得溶液的电导率变化如图所示。下列说法正确的是__________
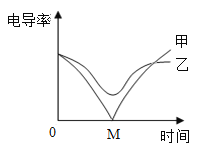
a.乙曲线电导率减小过程中,溶液由红色变为无色
b.乙曲线对应的反应中四种离子数目都减少
c.甲曲线对应氢氧化钡与硫酸钠反应
d.甲曲线上的 M 点代表两种溶液恰好完全反应