题目内容
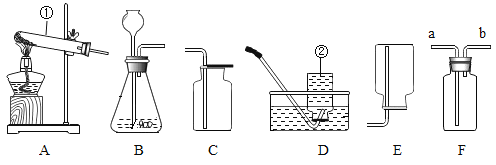
【题目】如图,甲、乙两图都是电解水的简易装置.回答下列问题.
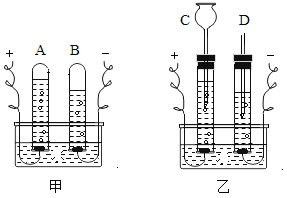
(1)装置甲比装置乙有一个明显的优点,这个优点是___.
(2)装置乙比装置甲有一个明显的优点,这个优点是___.
(3)在水中加入少量硫酸或氢氧化钠的目的是___.
(4)开始电解后,A管收集到___气,B管收集到___气体.
【答案】装置简单,便于操作 便于检验生成物 增强水的导电性 氧气 氢气
【解析】
(1)装置甲比装置乙有一个明显的优点,这个优点是装置简单,便于操作.
故填:装置简单,便于操作.
(2)装置乙比装置甲有一个明显的优点,这个优点是便于检验生成物.
故填:便于检验生成物.
(3)在水中加入少量硫酸或氢氧化钠的目的是增强水的导电性;故填:增强水的导电性.
(4)开始电解后,A管收集到气体体积较少,是氧气,B管收集到气体体积较多,是氢气;故填:氧气;氢气.

【题目】某实验小组选择“铜和硫酸反应的探究”的课题开展探究,下表是他们分别用相同质量的铜粉和足量硫酸反应的几组实验数据:
实验编号 | 硫酸的质量分数/% | 温度/℃ | 铜粉消失的时间/s |
① | 98 | 120 | 400 |
② | 98 | 200 | 200 |
③ | 80 | 120 | 500 |
④ | 80 | 200 | 280 |
⑤ | 70 | 200 | 不消失 |
⑥ | 40 | 200 | 不消失 |
(1)实验①、②表明:该反应快慢与__________有关,其关系是_______________;能表明硫酸浓度对反应快慢有影响的实验编号组合是_____________。
(2)如果把实验①中硫酸的质量分数改为85%,请你推出铜粉消失时间(用t表示)的取值范围_______。
(3)从上表来看,能与铜粉发生反应的硫酸溶液最低浓度a%的范围是_________(取整数)。
(4)影响金属和酸化学反应速度的因素除了上述因素以外还可能有____________________。
(拓展延伸)已知浓硫酸与铜粉加热时产生刺激性气体氧化物,同时溶液变蓝。如图是利用压强传感器测定浓硫酸与铜粉加热产生气体与NaOH溶液产生喷泉实验过程及压强变化曲线图。
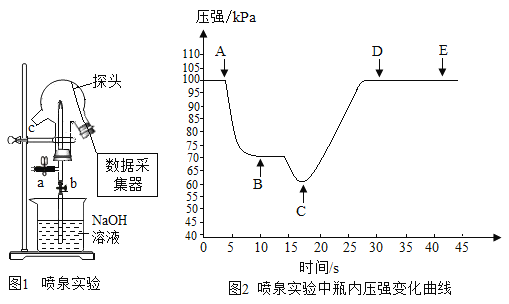
(5)请写出铜粉与浓硫酸加热生成刺激性气体和溶液变蓝的化学方程式_________________。
(6)实验过程:三颈瓶内装有收集满的气体,采集数据,将吸有NaOH溶液的胶头滴管塞紧颈口c,挤尽胶头滴管液体,然后打开阀门b,烧杯内的NaOH溶液喷到三颈瓶内形成喷泉,则曲线AB段下降的原因是_____________;CD段上升的原因是___________________。