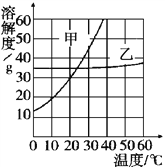
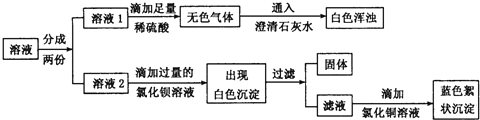
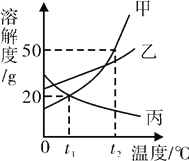
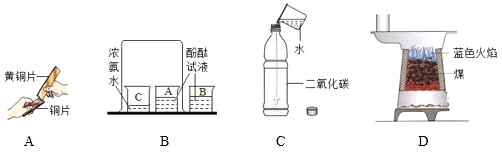
题目内容
【题目】(题文)小彬同学新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在 学习金属化学性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动。
(查阅资料)
①铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液……
(预测)三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
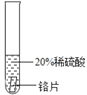
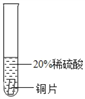
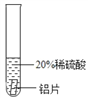
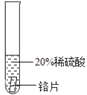
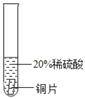
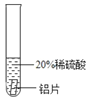
(实验过程)取大小相同的三种金属片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实 验 方案 |
|
|
|
实 验现象 | ______________ | ____________ | _______ |
结论 | 铬 与 稀 硫 酸 可 以 反应,速度较慢 | 铜不与稀硫酸反应 | _____ |
三种金属在金属活动性顺序表中的相对位置关系是_____ | |||
(回答问题)
(1)将上表中三处划横线的位置填上适当的内容。
(2)用砂纸打磨金属片的目的是_____。
(3)实验一所发生反应的化学方程式是_____。
(4)小东提出用硫酸铝溶液代替上述实验中的稀硫酸,小燕认为不可行,理由是_____。
(5)上述实验用了四种药品,小清认为只要选用三种药品进行实验就可以得出三种金属在 金属活动性顺序表中的相对位置关系,这三种药品可以是_____。
(6)实验发现,相等浓度的盐酸和硫酸,盐酸和铝反应的速率比硫酸快得多,可能的原因是:_____,请设计实验证明你的猜想____________。
【答案】 铬片表面产生气泡缓慢,溶液变蓝色 无现象 铝片表面产生气泡较为迅速 铝与稀硫酸反应速率较快 Al Cr Cu 除去金属表面氧化物 Cr+H2SO4═CrSO4+H2↑ 无法比较铬和铜的金属活动性强弱 Al、CrSO4溶液、Cu; Al2(SO4)3溶液、Cr、CuSO4溶液 Cl-更能促进反应 分别取等体积、等浓度的稀硫酸溶液于两支试管中,向其中一支试管加入少量的氯化钠固体,再将打磨后的等质量的铝片分别放入两支试管中,比较气泡放出快慢。
【解析】本题考查了金属活动性的探究。解题时注意控制变量法原理的应用。
(1)根据我们学过的知识可知,铜与稀硫酸不反应,根据图示现象可知,铝与稀硫酸反应比较快。结合铬也可以与硫酸反应,但反应比较慢,可得出三者的金属活动顺序为Al Cr Cu。因此:
实验一 | 实验二 | 实验三 | |
实 验 方案 |
|
|
|
实验现象 | 铬片的表面产生气泡缓慢,溶液变蓝色 | 无现象 | 铝片表面产生气泡较为迅速 |
结论 | 铬 与 稀 硫 酸 可 以 反应,速度较慢 | 铜不与稀硫酸反应 | 铝与稀硫酸反应速率较快 |
三种金属在金属活动性顺序表中的相对位置关系是Al Cr Cu | |||
(2)金属表面有一层氧化膜。用砂纸打磨金属片的目的是除去金属表面氧化物
(3)根据资料可知,铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液,方程式为:Cr+H2SO4=CrSO4+H2↑;
(4)硫酸铝不能与Cr、Cu反应,用硫酸铝溶液,只能证明Al比Cr、Cu活泼,无法比较铬和铜的金属活动性强弱;
(5)在验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属的盐溶液与两端金属的单质反应或取中间金属单质与两端的金属的盐溶液反应,因此可选用可以用Al、CrSO4溶液、Cu;也可以用Al2(SO4)3溶液、Cr、CuSO4溶液;
(6)实验发现,相等浓度的盐酸和硫酸,盐酸和铝反应的速率比硫酸快得多,盐酸溶液与硫酸溶液不同之处在于酸根离子不同。可能的原因是:Cl-更能促进反应;可通过控制变量法进行探究。分别取等体积、等浓度的稀硫酸溶液于两支试管中,向其中一支试管加入少量的氯化钠固体,再将打磨后的等质量的铝片分别放入两支试管中,比较气泡放出快慢。

【题目】煤和天然气是是当今社会重要的能源。
(1)写出天然气中甲烷完全燃烧的化学方程式_____
(2)天然气属于_____能源(填“可再生”或“不可再生”),分析下表,与煤相比,用天然气作燃料的优点有_____。
1g 物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/KJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |
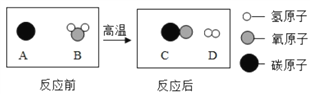
(3)为提高煤的利用率,可将其转化为可燃性气体,该反应的微观示意图如下,写出该反应化学方程式_______;
(4)液态二氧化碳可用于扑救档案室发生的火灾,下列说法不正确的是________填字母序号)。
A.液态二氧化碳汽化后不会污染档案 B.二氧化碳可覆盖在可燃物表面,隔绝空气 C.液态二氧化碳汽化时吸热,降低可燃物的着火点