题目内容
【题目】小刚在商场发现点燃后怎么也“吹不灭”的蜡烛,他买回来和学习小组同学进行了下列探究。(查阅资料)普通蜡烛由石蜡和蜡烛芯制成,而吹不灭的蜡烛是在蜡烛芯上包裹一层打火石的粉末,打火石是由某种金属掺入少量稀土元素制成的合金,它的着火点只有150℃,当蜡烛燃烧时,金属并不燃烧;但当蜡烛吹灭后,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
(请教老师)老师告诉同学们,蜡烛芯内打火石中的某种金属是镁、铁、铜三种金属中的一种。
(进行实验)为确定该金属的成分,大家设计了以下实验方案。(不考虑打火石中的稀土元素对金属性质的探究)。
实验操作步骤 | 实验现象 | 实验结论 |
1.切开蜡烛,取出打火石,用砂纸打磨。 | 打火石呈银白色。 | 该金属一定不是___。 |
2.取少量打磨后的打火石于试管中,滴加____。 | 有无色气体产生,反应后的溶液呈____色。 | 该金属一定不是铁,而是镁。 |
(反思交流)
(1)实验2中反应的化学方程式为____。
(2)这种蜡烛燃烧时,蜡烛芯里的金属为什么不燃烧?_____;当吹灭蜡烛时,烛芯中的金属燃烧的化学方程式为_____。
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,你采用的方法是____。
【答案】铜 稀盐酸或稀硫酸 无 ![]() 或
或![]() 蜡烛烛芯被石蜡蒸气包围着,缺少氧气,里面的金属难以燃烧
蜡烛烛芯被石蜡蒸气包围着,缺少氧气,里面的金属难以燃烧 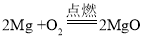 隔绝氧气或剪除烛芯或用湿抹布盖灭
隔绝氧气或剪除烛芯或用湿抹布盖灭
【解析】
探究蜡烛芯内打火石中的金属成分:
进行实验:
实验操作步骤1:切开蜡烛,取出打火石,用砂纸打磨;
实验现象:打火石呈银白色;
实验结论:该金属一定不是铜,因为金属铜呈红色。
根据实验操作步骤2的实验结论“该金属一定不是铁,而是镁”推导实验操作步骤2和实验现象,因为铁与稀盐酸或稀硫酸反应生成氯化亚铁或硫酸亚铁,溶液呈浅绿色,镁与稀盐酸或稀硫酸反应生成氯化镁或硫酸镁,溶液呈无色,则有:
实验操作步骤2:取少量打磨后的打火石于试管中,滴加稀盐酸或稀硫酸;
实验现象:有无色气体产生,反应后的溶液呈无色。
反思交流:
(1)实验2中的反应即镁与稀盐酸或镁与稀硫酸反应,反应的化学方程式为![]() 或
或![]() 。
。
(2)这种蜡烛燃烧时,蜡烛芯里的金属不燃烧的原因是蜡烛烛芯被石蜡蒸气包围着,缺少氧气,里面的金属难以燃烧;当吹灭蜡烛时,烛芯中的金属镁燃烧生成氧化镁,反应的化学方程式为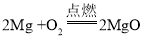 。
。
(3)这种“吹不灭”的蜡烛实际上也可以熄灭,可以采用的方法是隔绝氧气或剪除烛芯或用湿抹布盖灭等。