题目内容
【题目】化学兴趣小组在解老师的带领下探究“饱和氢氧化钙溶液导电性"实验时(如图),发现了一个意外现象:两根石墨电极两端产生氢气、氧气以外,饱和澄清石灰水中出现了白色浑浊。为此,小组同学展开了如下探究。
[提出问题]为什么出现白色浑浊?
[猜想与假设]
甲:可能是饱和溶液电解时________减少,氢氧化钙固体析出导致的浑浊;
乙:可能是饱和溶液通电时温度升高,氢氧化钙固体析出导致的浑浊;
丙:可能是电解过程中产生的___________与饱和石灰水反应导致的浑浊。
[进行实验]小组同学分别设计了如下实验方案验证。
实验步骤 | 实验现象 | 实验结论 | |
甲 | 将90mL相同浓度的饱和澄清石灰水中加入10mL蒸馏水,在相同的电压下再次进行电解实验,观察现象 | _______________。 | 甲同学猜想不正确 |
乙 | 取_____________于烧杯中,加热至电解实验中上升的相同温度,观察现象 | 溶液不变浑浊 | 乙同学猜想____。 |
丙 | 向电解得到浑浊液体中加入足量的稀盐酸,观察现象 | 浑浊消失,有气泡产生。该反应化学方程式为____________。 | 丙同学猜想正确 |
[拓展延伸][注意:若答对以下问题可奖励4分,化学试卷总分不超过60]
为进一步研究丙同学实验后废液成分性质,丁同学取一定质量的废液,逐滴加入溶质质量分数为10.6%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示:
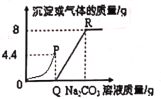
①P点时的溶液中的溶质是____________________(写名称);
②R点对应横坐标的数值为______________________;
③Q至R段表示_________________________________的过程。
【答案】水 二氧化碳 溶液变浑浊 氢氧化钙饱和溶液 不正确 CaCO3+2HCl=CaCl2+H2O+CO2↑ 氯化钙和氯化钠 180 氯化钙与碳酸钠溶液的反应
【解析】
{猜想与假设}电解时氢氧化钙饱和溶液中的水减少,溶液中不能溶解的部分氢氧化钙结晶析出,故填水;
电解时碳棒中的部分碳与氧气反应生成二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,故填二氧化碳。
{进行实验}甲同学猜想不正确,则沉淀的生成与水的减少无关,那么加水后继续电解,观察到溶液仍变浑浊,故填溶液变浑浊;
乙同学推测温度升高,氢氧化钙的溶解度减小,氢氧化钙结晶形成晶体是溶液变浑浊,所以可取氢氧化钙饱和溶液于烧杯中,加热至电解实验中上升的相同温度,观察现象,故填氢氧化钙饱和溶液;
实验现象为溶液不变浑浊,说明温度升高,没有氢氧化钙固体析出,证明乙同学猜想不正确,故填不正确;
向电解得到浑浊液体中加入足量的稀盐酸,浑浊消失,有气泡产生,证明浑浊液体中的不溶物为碳酸钙,发生的反应是碳酸钙与元素反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
{拓展延伸}①丙同学实验后的废液中含有氯化钙和稀盐酸,加入碳酸钠然以后,碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳,由图可知,反应至P点时,碳酸钠与盐酸恰好完全反应,生成二氧化碳的质量为4.4g,此时溶液中的溶质为氯化钙和氯化钠,故填氯化钙和氯化钠;
②解:设生成4.4g二氧化碳消耗的碳酸钠溶液的质量为x

106:44=(x×10.6%):4.4g
x=100g
设生成8g碳酸钙需要碳酸钠溶液的质量为y

106:100=(y×10.6%):8g
y=80g
参加反应的碳酸钠溶液的质量为100g+80g=180g
则R点对应横坐标的数值为180,故填180;
③由图可知,Q点时盐酸与加入的碳酸钠溶液恰好完全反应,R点时氯化钙与加入的碳酸钠溶液恰好完全反应,则Q至R段表示氯化钙与碳酸钠溶液的反应,故填氯化钙与碳酸钠溶液的反应。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案