题目内容
(6 分) 早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置测定某赤铁矿石中氧化铁的质量分数。请按要求回答问题: 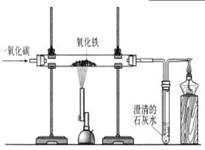
(1)实验中玻璃管里氧化铁粉末的颜色变化是 。
(2)实验开始时先向大玻璃管中通入 CO,一段时间后再加热的原因是 。
(3)现用足量一氧化碳与 12g赤铁矿石充分反应后,盛石灰水的装置质量增重 8.8g(矿石中杂质不参与反应,生成的气体全部被吸收) 。计算赤铁矿石中氧化铁的质量分数。
(1)红色粉末变成黑色
(2)排尽玻璃管中的空气,防止加热一氧化碳与空气的混合气体发生爆炸
(3) 89.2%
解析试题分析:(1)工业上炼铁的原理是利用一氧化碳和氧化铁的反应,方程式:3CO+ Fe2O3高温2Fe + 3CO2,生成的铁粉为黑色,所以实验中玻璃管里氧化铁粉末的颜色变化是:红色粉末变成黑色
(2)一氧化碳具有可燃性,不纯的时候点燃或加热可能发生爆炸,所以实验开始时先向大玻璃管中通入 CO,一段时间后再加热的原因是:排尽玻璃管中的空气,防止加热一氧化碳与空气的混合气体发生爆炸
(3)一氧化碳和氧化铁的反应生成二氧化碳,进入到石灰水中,所以盛石灰水的装置质量会增重,增重的质量即为二氧化碳的质量,再根据方程式:3CO+ Fe2O3高温2Fe + 3CO2中Fe2O3与CO2的质量关系,即可算出Fe2O3的质量,进而可计算赤铁矿石中氧化铁的质量分数
解:设该矿石中氧化铁的质量为 x
3CO+ Fe2O3高温2Fe + 3CO2
160 132
x 8.8g
160 :132 = x : 8.8
x= 10.7 g
∴矿石中氧化铁的质量分数为: 10.7g/12g×100% ="=" 89.2%
考点:工业上炼铁的原理,根据化学方程式进行的计算

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案(7分)锌锰电池(俗称干电池)在生活中的用量很大。锌锰电池的构造
如图所示。回答下列问题: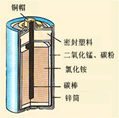
(1)锌锰电池所使用的下列材料中,属于金属材料的是 (填字
母序号)。
| A.铜帽 | B.碳棒 | C.锌筒 | D.密封塑料 |
(3)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,该反应中锰元素的化合价由+4变为 。
(4)利用废旧电池铜帽(含Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下:
(已知:Cu+H2O2+H2SO4=CuSO4+2H2O)
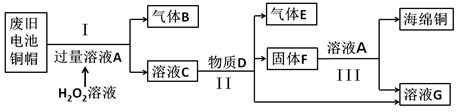
①过程Ⅲ中分离操作的名称是 。
②过程Ⅱ中发生反应的化学方程式为 。
构建知识网络,可以帮助我们理解知识间的内在联系,如图是关于铁化学性质的知识网络.请回答下列问题: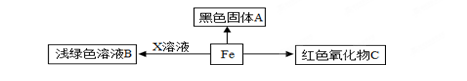
(1)铁丝在氧气中燃烧生成黑色固体A,写出A的化学式
(2)写出防止铁生锈的一种方法
(3)若要证明Fe、Cu、Ag三种金属的活动性顺序,只需选用Fe、Ag和X溶液三种试剂,X是 溶液,写出发生反应的化学方程式 ,该反应的基本类型是 .
(4)若X为稀硫酸,向Fe和X溶液反应后的溶液中加入一定量的锌粉,有气泡产生,充分反应后过滤,得到滤渣和滤液,下列对滤渣和滤液中溶质的成分分析正确的是
| A.滤液中一定含有FeSO4和ZnSO4 | B.滤渣中只含有Fe |
| C.滤液中一定含有ZnSO4 | D.滤渣中一定含有Zn和Fe. |