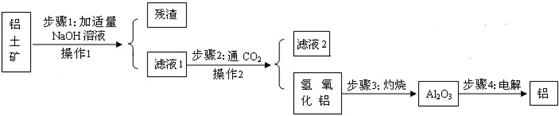
题目内容
(7分)锌锰电池(俗称干电池)在生活中的用量很大。锌锰电池的构造
如图所示。回答下列问题: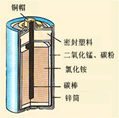
(1)锌锰电池所使用的下列材料中,属于金属材料的是 (填字
母序号)。
| A.铜帽 | B.碳棒 | C.锌筒 | D.密封塑料 |
(3)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,该反应中锰元素的化合价由+4变为 。
(4)利用废旧电池铜帽(含Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下:
(已知:Cu+H2O2+H2SO4=CuSO4+2H2O)
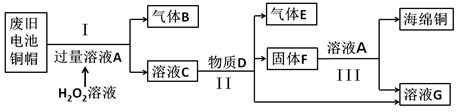
①过程Ⅲ中分离操作的名称是 。
②过程Ⅱ中发生反应的化学方程式为 。
(1)AC (2)与氧气、水同时接触 CO2 (3)+3(4)①过滤 ②Zn+ CuSO4= ZnSO4+Cu Zn+H2SO4=ZnSO4+H2↑
解析试题分析:(1)锌锰电池所使用的下列材料中,属于金属材料的是铜帽、锌筒;(2)有所学知识可知铁生锈的条件是与氧气、水同时接触,根据质量守恒定律可推知废旧电池的铜帽会生成一些绿色的铜锈,其主要成分为是Cu2(OH)2CO3,则铜生锈还必须有二氧化碳参与;(3)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH,该反应中锰元素的化合价由+4变为+3价,依据化学式中元素的正负化合价的代数和为零计算,在化学式中氢的化合价为+1,氧的化合价为-2,设锰的化合价为X,X+(-2)×2+1=0,得到X=+3;(4)因为过程Ⅲ是固液分离所以操作的名称为过滤;有操作的目的可知,制取海绵铜(Cu),并得到硫酸锌溶液过量的A溶液为硫酸溶液,在过氧化氢和硫酸的共同作用下,金属锌和铜转化为硫酸锌和硫酸铜,物质D为加入的金属锌,置换金属铜,同时金属锌和过量的稀硫酸反应生成氢气和硫酸锌,涉及的化学方程式为:Zn+ CuSO4= ZnSO4+Cu ; Zn+H2SO4=ZnSO4+H2↑
考点:金属材料、金属活动性顺序、物质的推断

化学实验是学习化学的重要方法.请完成下列金属性质的实验.
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
| 实验步骤 | 实验现象 | 结 论 |
| | | 金属活动性:Fe>Cu |
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]①三个反应的共同特点是 ,写出其中一个反应的化学方程式 .
②若完全反应后,三个反应生成氢气的质量相等,原因是 .
(8分)2014年央视 “3.15”晚会上曝出某品牌金饰品掺假的事件,引起同学们的好奇。小明同学拿来一片黄色的金属,和小军同学一起进行了相关探究活动。
【猜 想】①小明认为是黄金 ②小军认为是铜锌合金
【设计实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取一小片黄色金属放在石棉网上用酒精灯加热 | 黄色的金属变黑 |
| ② | 取一小片黄色的金属放入稀硫酸中 | |
(1)由实验①可知,猜想 (填序号)正确;写出反应的化学方程式
。
(2)实验②中的现象是 ,写出反应的化学方程式
。
【反思应用】假设你的观点和小军相同,请你选用一种类别不同于稀硫酸的试剂,再设计一个实验:取一小片黄色的金属放入 溶液中,实验中观察到的现象是 。