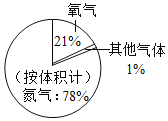
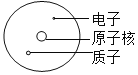
题目内容
【题目】Ⅰ.请根据示例写出下列空格中对应的化学符号或符号所表达的含义。
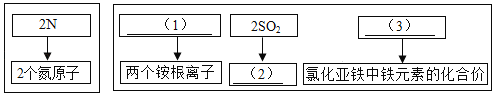
(1)______________________(2)_____________________(3)_______________________
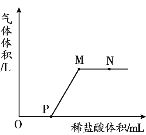
Ⅱ.M元素的单质是当今世界高科技领域发展较快,用途较广的有色材料,如可做火箭头、导弹点火头、航天器元部件及照明弹等,其原子结构示意图如图
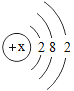
(1)M元素的名称是_____________________,位于周期表中第_____________________周期。
(2)M元素的化学性质与下列_____________________(填字母)元素的化学性质相似。
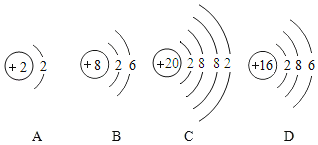
(3)M元素的离子符号是_____________________。
(4)M元素与地壳中含量最多的非金属元素形成化合物的化学式_____________________。
Ⅲ.利用你所学的化学知识,完成下列相关问题:
(1)50mL水与50mL乙醇混合后,溶液体积小于100mL,从分子的角度解释为_____________________。
(2)蜡烛在空气中燃烧得到二氧化碳和水,说明蜡烛肯定含有的元素有_____________________。(填元素符号)
(3)在装有空气的密闭容器中,欲用燃烧的方法除去其中的氧气,又不混入其它气体,下列物质中符合条件的是_____________________(填字母)。
A 木炭 B 硫 C 红磷 D 铁丝
(4)写出铁燃烧的现象_____________________,该反应的文字(化学式)表达式是_____________________。
【答案】2![]() 两个二氧化硫分子
两个二氧化硫分子 ![]() 镁 三 C Mg2+ MgO 分子间有间隙 C、H C 剧烈燃烧,火星四射,放出热量,生成一种黑色固体
镁 三 C Mg2+ MgO 分子间有间隙 C、H C 剧烈燃烧,火星四射,放出热量,生成一种黑色固体 ![]()
【解析】
Ⅰ.(1)两个铵根离子可以表示为2NH4+;
(2)2SO2表示两个二氧化硫分子;
(3)氯化亚铁中铁元素化合价是+2,可以表示为![]() 。
。
故答案为:2NH4+;两个二氧化硫分子;![]() 。
。
Ⅱ.(1)当质子数=核外电子数,为原子,x=2+8+2=12,其核内质子数为12,为镁元素。
周期数=原子核外电子层数,M元素的原子核外有3个电子层,则在元素周期表中,该元素位于第3周期。
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,M元素的最外层电子数为2,C中最外层电子数也为2,最外层电子数相同,化学性质最相似。A中原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;尽管最外层电子数相同,但它们化学性质不相似。
(3)M原子的核内质子数为12,为镁原子;M原子的最外层电子数为2,在化学反应中易失去2个电子而形成带2个单位正电荷的阳离子,其离子符号为Mg2+。
(4)M元素为镁元素,与地壳中含量最多的非金属元素为氧元素,镁元素显+2价,氧元素显-2价,形成的化合物为:MgO。
故答案为:
(1)镁;3;(2)C;(3)Mg2+;(4)MgO.
Ⅲ.(1)50mL水与50mL乙醇混合后,溶液体积小于100mL,说明分子之间有间隔。
故填:分子之间有间隙。
(2)探究汽油的组成,将汽油点燃,验证生成物,从而判断所含的元素。在火焰的上方罩一个干燥的冷烧杯,烧杯壁上有水雾,证明有氢元素。然后将内壁蘸有石灰水的烧杯罩在火焰的上方,石灰水变浑浊,证明有碳元素。故填:C、H。
(5)A、木炭和氧气燃烧生成气体二氧化碳,增加了气体杂质; 故此选项错误。
B、硫在空气中燃烧生成气体二氧化硫,增加了气体杂质。故此选项错误。
C、红磷和氧气生成五氧化二磷,为固体,不会增加气体杂质;此项正确;
D、铁丝在空气中不能燃烧,故此选项错误。
(4)铁丝燃烧的现象是:剧烈燃烧,火星四射,放出大量的热,生成黑色固体;
该反应的文字表达式为:铁+氧气 ![]() 四氧化三铁;
四氧化三铁;
故答案为:
(1)分子之间有间隙;(2)C、H;(3)C;(4)剧烈燃烧,火星四射,放出热量,生成一种黑色固体;铁+氧气 ![]() 四氧化三铁。
四氧化三铁。

【题目】小明取酸性锌锰干电池进行探究,他发现电池内部结构如图所示。

(查阅资料)(1)锌皮为金属锌(含有少量的铁);
(2)黑色糊状填充物由炭黑、MnO2、ZnCl2和NH4Cl等组成;
(3)有关数据见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
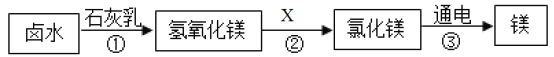
(实验探究一)小明取适量黑色糊状填充物,按下图所示实验流程进行探究。
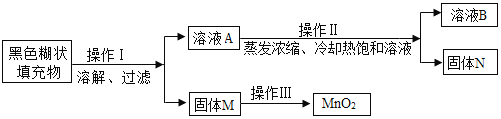
(1)溶液A中溶质主要有______________(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是_____________。
(2)欲从固体M中得到较纯的MnO2,操作Ⅲ可采用的简便方法是________________________。
(实验探究二)小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
① 实验中可观察到的现象是____________________________;该反应属于基本反应类型中的______________反应。
② 下列各组物质混合后,也能生成ZnCl2的有______________(填字母序号)。
A.ZnO与稀盐酸 B.ZnSO4溶液与BaCl2溶液
C.ZnCO3与NaCl溶液 D.Zn(NO3)2溶液与NH4Cl溶液
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F。当溶液E中只含一种溶质时,该溶质是______________(填化学式);当固体F中只含一种物质时,溶液E中最少含有___________种溶质。
(3)若将6.5 g锌皮与足量稀硫酸完全反应,则生成氢气的质量______0.2 g(选填“<”、“>”或
【题目】某校化学小组的同学取石灰石样品12g加入烧杯中,再把80g稀盐酸分四次加入,实验过程所得数据如下表所示(已知石灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
加入稀盐酸的质量 | 20 | 20 | 20 | 20 |
剩余固体的质量 | 8 | 4 | 2 | 2 |
分析表中数据,完成下列问题:
(1)该石灰石样品中碳酸钙的质量为______________g;
(2)计算第一次实验结束后所得的溶液中溶质质量分数____________。