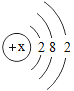题目内容
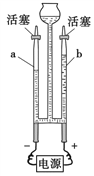
【题目】小明取酸性锌锰干电池进行探究,他发现电池内部结构如图所示。

(查阅资料)(1)锌皮为金属锌(含有少量的铁);
(2)黑色糊状填充物由炭黑、MnO2、ZnCl2和NH4Cl等组成;
(3)有关数据见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 | |
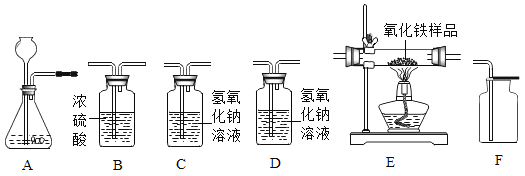
(实验探究一)小明取适量黑色糊状填充物,按下图所示实验流程进行探究。
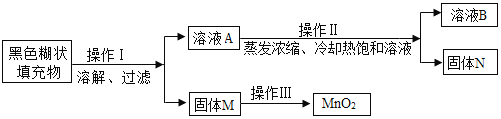
(1)溶液A中溶质主要有______________(填化学式),操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是_____________。
(2)欲从固体M中得到较纯的MnO2,操作Ⅲ可采用的简便方法是________________________。
(实验探究二)小明取电池外壳锌皮,用砂纸打磨干净,剪成小块,进行实验。
(1)取一块锌皮放入盛有适量稀盐酸的烧杯中,有ZnCl2生成。
① 实验中可观察到的现象是____________________________;该反应属于基本反应类型中的______________反应。
② 下列各组物质混合后,也能生成ZnCl2的有______________(填字母序号)。
A.ZnO与稀盐酸 B.ZnSO4溶液与BaCl2溶液
C.ZnCO3与NaCl溶液 D.Zn(NO3)2溶液与NH4Cl溶液
(2)另取一块锌皮放入盛有一定量CuSO4溶液的烧杯中,充分反应后得到溶液E和固体F。当溶液E中只含一种溶质时,该溶质是______________(填化学式);当固体F中只含一种物质时,溶液E中最少含有___________种溶质。
(3)若将6.5 g锌皮与足量稀硫酸完全反应,则生成氢气的质量______0.2 g(选填“<”、“>”或
【答案】NH4Cl、ZnCl2 两者的溶解度受温度变化的影响不同 在空气中充分燃烧 固体溶解,有大量气泡产生 置换 A、B ZnSO4 2 >
【解析】
(1)黑色糊状填充物中的NH4Cl、ZnCl2易溶于水,操作Ⅱ中采用冷却热饱和溶液的方法实现两者分离的依据是两者的溶解度受温度变化的影响不同。(2)在空气中充分燃烧,以除去炭黑。【实验探究二】(1)①锌与盐酸反应生成氢气,单化化单是置换。②A.ZnO+2HCl=ZnCl2+H2O,正确;B.ZnSO4+BaC12==BaSO4↓+ZnCl2,正确;C.ZnCO3与NaCl溶液不反应,错误;D.Zn(NO3)2溶液与NH4Cl溶液不反应,错误。故选AB。(2)Zn+CuSO4=ZnSO4+Cu,Fe+CuSO4=FeSO4+Cu,金属活动性顺序相差大的之间先反应,故Zn+CuSO4=ZnSO4+Cu先反应。当溶液E中只含一种溶质时,该溶质是ZnSO4,当固体F中只含一种物质时,该固体物质是铜,溶液E中最少含有ZnSO4、FeSO4两种溶质。③6.5g纯净的锌与足量稀硫酸反应,生成0.2g氢气,等质量的锌、铁与酸反应,铁生成氢气多,将含有铁的6.5g锌皮与足量稀硫酸完全反应,生成氢气的质量>0.2g。

【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为____。
(2)制取氢氧化铜的化学方程式为____。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
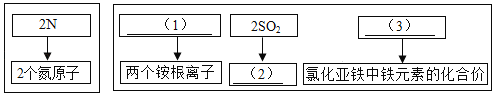
(提出猜想)红色固体是:Ⅰ.Cu;Ⅱ.Cu2O;Ⅲ.①____。
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:②____。 |
②过滤、洗涤、干燥。 | 得红色固体 |
(进行实验)
(结论分析)
③据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想___也有相同的现象。
④为了进一步确定1.44g红色固体的成分,同学们将充分反应的固体过滤、洗涤、干燥后称重为1.24g,通过计算后确定猜想Ⅲ正确,请你计算出1.44g红色固体中Cu为____g、Cu2O为______g。