题目内容
【题目】我国海洋资源丰富,开发前景十分远大。从海洋中提取的金属镁可以广泛应用于生活、生产和国防工业。
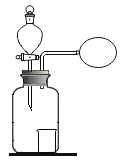
(1)从海水中提取单质镁的过程如下图所示:
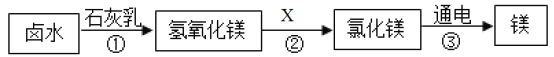
Ⅰ.写出上述转化过程①中,氯化镁溶液与石灰乳发生反应的化学方程式_________。
Ⅱ.过程②中加入的试剂X的名称为__________.
(2)某化学兴趣小组对一份MgCl2和Mg(OH)2的混合粉末展开了探究。取10 gMgCl2和Mg(OH)2的固体混合物于烧杯中,向其中逐滴加入溶质质量分数为10%的稀盐酸,烧杯中固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答下列问题:
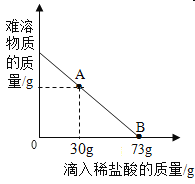
Ⅰ.在滴入稀盐酸的过程中,观察到的明显实验现象________。
Ⅱ.当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式)_________。
Ⅲ.当滴入10%的稀盐酸73g时(即B点),试通过计算,求此时所得不饱和溶液中溶质的质量________。(计算结果精确到0.lg)
【答案】MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 稀盐酸 固体逐渐溶解 MgCl2 13.7g
【解析】
(1)Ⅰ.氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。故填:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。
Ⅱ.氢氧化镁难溶于水,与稀盐酸反应能生成氯化镁和水,故试剂X为稀盐酸。故填:稀盐酸。
(2)Ⅰ.氢氧化镁和稀盐酸反应生成氯化镁和水,在滴入稀盐酸的过程中,观察到的明显实验现象是固体逐渐溶解。故填:固体逐渐溶解。
Ⅱ.当滴入10%的稀盐酸至图中A点时,固体中氢氧化镁还没反应完全,烧杯中溶液里含有的溶质是氯化镁;故填:MgCl2。
Ⅲ.设样品中氢氧化镁的质量为x,反应生成的氯化镁的质量为y
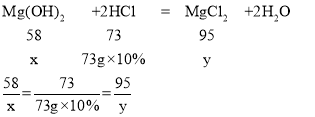
解得x=5.8g,y=9.5g
所得不饱和溶液中溶质的质量为10g-5.8g+9.5g=13.7g
答:所得不饱和溶液中溶质的质量为13.7g。
故填:13.7g。