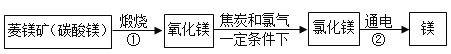
��Ŀ����
����Ŀ��̽�������о�������̼����ȡ

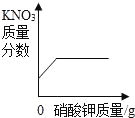
(1)ͬѧ�ǰ�������ʵ�飬ȡ��������ʯ��ʯ�ֱ�������ֲ�ͬ����(���ʲ����ᷴӦ)��������ʵ�飬����������̼�����ʱ��仯������ͼ1��ʾ��
ʵ���� | ҩƷ |
�� | ��״����ʯ��10%ϡ������Һ |
�� | ��״����ʯ��7%ϡ������Һ |
�� | ����ʯ��ĩ��7%ϡ������Һ |
��ͼ�б����߶�Ӧʵ��_____(ѡ������������������������)��
��С��ͬѧ����ȷ����ͼ�������߶�Ӧ��ҩƷ�Ʊ�������̼����Ӧ����ʽΪ_____��
�۲���ͼ1�м����߶�Ӧ��ҩƷ��������_____��
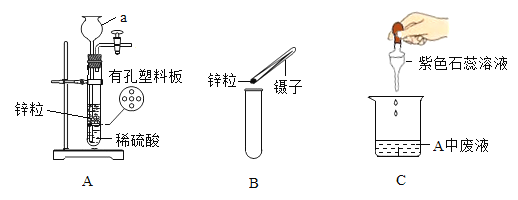
(2)��ʵ����ͬѧ��ѡ��ͼ2װ����ȡ�Ƚϴ����������CO2��
��Bװ���з�����Ӧ�Ļ�ѧ����ʽΪ_____��
��Cװ����Ũ�����������_____��
������D�м�Ҫ������CO2���ռ�װ��ͼ��_____
(3)ȡ12.5gʯ��ʯ��װ��A�У������м���100g������ϡ���ᣬ��ַ�Ӧ��(���ʲ��μӷ�Ӧ)������Ϊ108.1g������㣺
�ٷ�Ӧ���ɶ�����̼���������Ϊ_____g��
�ڳ�ַ�Ӧ��Aװ���ڵĻ�����к����Ȼ��Ƶ�����Ϊ_____g��
�۸�ʯ��ʯ��̼��Ƶ���������Ϊ_____��
(4)��Ӧ��������Һ�е����ʳɷ���ʲô��
����һ��CaCl2�� �������CaCl2��HCl��
�ٿ�ѡ�����������е�_____(����ĸ)������֤��
A þ�� B ͭƬ C ��̪��Һ D ������Һ E ��������Һ F ̼��Ʒ�ĩ
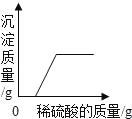
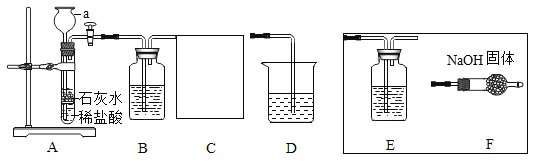
��ʵ���ȷ�ϲ������ȷ��ȡ����������Ӧ��������Һ����ε���̼������Һ������pH������������⣬�õ���ͼ3����(������ΪpH��������Ϊʱ��)����ͼ������д��BC���ڷ����Ļ�ѧ��Ӧ����ʽΪ_____��ͼ��CD��������ԭ����_____��
���𰸡��� CaCO3+2HCl=CaCl2+CO2��+H2O ����������ٶȹ��죬�������ռ� NaHCO3+HCl=NaCl+H2O+CO2�� ��ȥ������̼�л��е�ˮ���� 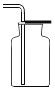 4.4 11.1 80% AF Na2CO3+CaCl2=2NaCl+CaCO3�� ̼���ƹ�����̼������Һ�Լ���
4.4 11.1 80% AF Na2CO3+CaCl2=2NaCl+CaCO3�� ̼���ƹ�����̼������Һ�Լ���
��������
��1���ٱ����߱�ʾ�����Ķ�����̼���٣�����ʵ�����Ϊ����ʯ�е�̼��������ᷴӦ���ɵ��������һ������ˮ�����ʣ��ḽ���ڴ���ʯ�ı������ֹ��Ӧ�Ľ�һ�����������Բ����Ķ�����̼���٣�
�������Ҵ����Ļ�ѧ��Ӧ���ɵĶ�����̼�϶࣬�ҷ�Ӧ�����ʿ������У��������ǿ�״����ʯ��7%��ϡ���ᷢ���ķ�Ӧ����ѧ����ʽΪCaCO3+2HCl��CaCl2+CO2��+H2O��
�ۼ��з�Ӧ̫���ң��������ռ�������̼�����Բ��ü�Ӧ��ҩƷ��
��2�����Ʊ��Ķ�����̼�л����������Ȼ������壬�Ȼ�����������ˮ�γ����ᣬ̼�����ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽNaHCO3+HCl�TNaCl+H2O+CO2������װ�ÿ��Գ�ȥ������̼�л��е��Ȼ��⣻
��Ũ���������ˮ�ԣ�����Cװ����Ũ������Գ�ȥ������̼�л��е�ˮ������
�۶�����̼���ܶȱȿ�����������ˮ������Ӧ�ò��������ſ��������ռ�������̼����ͼ�� ��
��
��3�����������غ㶨�ɿ�֪�����ɶ�����̼������Ϊ��12.5g+100g��108.1g��4.4g��
��������4.4g������̼��ͬʱ�����Ȼ��Ƶ�����Ϊx����Ҫ̼��Ƶ�����Ϊy����
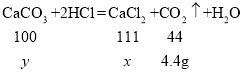
![]() x��11.1g��
x��11.1g��
![]() y��10g��
y��10g��
�۸�ʯ��ʯ��̼��Ƶ���������Ϊ![]() ��
��
��4�����Ȼ�����Һ�����ԣ����������ԡ�þ��̼��ƶ��������ᷴӦ�������壬�Ȼ��ƺ������������������Ӧ���ɰ�ɫ���������������������������Ӧ�����Կ���þ����̼��������飬��ѡAF��
����ͼ���֪��BC����Һ��pHû�иı䣬����̼���ƺ��Ȼ��Ʒ�Ӧ�����Ȼ��ƺ�̼��Ƴ����Ĺ��̣���Ӧ�Ļ�ѧ����ʽNa2CO3+CaCl2��2NaCl+CaCO3����CD�������Ҵ���7��ԭ����̼���ƹ�����̼������Һ�Լ��ԡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������ͼ��������ʵ��������ǣ�������
A | B | C | D |
��һ����п���м������ϡ���� | ��һ�����Ȼ�隣�����Һ�в��ϼ���ˮ | t��ʱ����һ���������͵��������Һ�в��ϼ�������ؾ��� | ��һ�����������ƺ����������Ļ����Һ�м���ϡ���� |
|
|
|
|
A. AB. BC. CD. D
����Ŀ����20�滷���У���ȡ����Ķ�����̼���壬����֤������̼����������������Һ���Է�����ѧ��Ӧ�������ͼ̽��ʵ�顣
���������ϣ�
��1��̼���ơ�ˮ��������̼���Ի�������̼�����ơ�
��2��20�棬�������ơ�̼���ƺ�̼�����Ƶ��ܽ�����±���ʾ��
���� | �������� | ̼���� | ̼������ |
�ܽ��/g | 110 | 21.8 | 9.6 |
������̽����
��1��װ��F�е�����IJ�������������_____��
��2��װ��B��ʢ��̼��������Һ��Ŀ��������װ��A�лӷ������Ȼ������壬д��B�з�����Ӧ�Ļ�ѧ����ʽ��_____��
��3��װ��C��������_____��ѡ��_____��ѡ��E��F��װ�ôﵽʵ��Ŀ�ġ�
��4����ʵ�������װ��D�й۲쵽_____��˵��������̼������������Һ�ܷ�����ѧ��Ӧ��
����Ŀ��ijͬѧ��ѧϰ�й����ˡ������仯����ļۡ����ϵͼ����
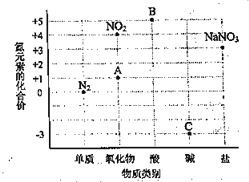
(1)д��ͼ��A��B��C���Ӧ���ʵĻ�ѧʽ��������________ ��________ ��________��
(2)��ͼ�еĵ��Ӧ���ʲ�����ϵĻ�ѧʽ��________��
(3)�ڴ������У�����________ ���������Ƿֳɵ��ʺͻ����
(4)��������________������ӡ�����ԭ�ӡ������ӡ������ɵġ�
(5)��ɼ�������غ���������ֹ��廯�ʵ�ʵ�鱨�档
ʵ�鲽�� | ʵ������ | ʵ����� |
________ | ________ | ________ |
����Ŀ����ͼ��ʾװ��(����������)�����Ƚ�����Һ�������У��۲쵽�������Թ���һ�� ʱ���ָ���ԭ״���ٽ�����Һ����붡�У����������Թ������������ȷ����( )
ѡ�� | �ιܼ� | �ձ��� | �ι��� | �ձ��� |
A | ����������Һ | �������� | ˮ | �Ȼ��� |
B | ϡ���� | п | ���� | ̼���� |
C | ˮ | �������� | ˮ | ����� |
D | ˮ | ������ | ���� | þ |
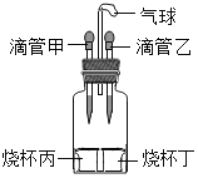
A. AB. BC. CD. D