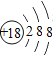题目内容
【题目】在pH=2的无色溶液中,下列离子能大量共存的是( )
A.Ag+、Mg2+、![]() B.Ba2+、
B.Ba2+、![]() 、
、![]()
C.K+、OH﹣、![]() D.NH4+、Fe2+、Cl﹣
D.NH4+、Fe2+、Cl﹣
【答案】A
【解析】
pH为2的水溶液显酸性,水溶液中含有大量的H+。
A、三种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,且不存在有色离子,故选项正确;
B、Ba2+、SO42﹣在溶液中能结合生成不溶于酸的硫酸钡沉淀,HCO3﹣、H+能结合生成水和二氧化碳,不能在酸性溶液中大量共存,故选项错误;
C、OH﹣和H+在溶液中能结合生成水,CO32﹣、H+能结合生成水和二氧化碳,不能在酸性溶液中大量共存,故选项错误;
D、三种离子间不能结合成沉淀、气体或水,能在酸性溶液中大量共存,但Fe2+的水溶液显浅绿色,故选项错误。
故选A。

 手拉手全优练考卷系列答案
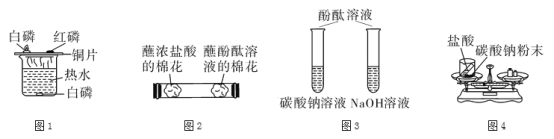
手拉手全优练考卷系列答案【题目】探究二、研究二氧化碳的制取

(1)同学们按表进行实验,取等质量的石灰石分别加入两种不同的酸(杂质不与酸反应)进行三次实验,产生二氧化碳体积随时间变化曲线如图1所示。
实验编号 | 药品 |
Ⅰ | 块状大理石、10%稀硫酸溶液 |
Ⅱ | 块状大理石、7%稀盐酸溶液 |
Ⅲ | 大理石粉末、7%稀盐酸溶液 |
①图中丙曲线对应实验_____(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②小组同学讨论确定用图中乙曲线对应的药品制备二氧化碳,反应方程式为_____。
③不用图1中甲曲线对应的药品,理由是_____。
(2)在实验室同学们选用图2装置制取比较纯净、干燥的CO2。
①B装置中发生反应的化学方程式为_____;
②C装置中浓硫酸的作用是_____;
③请在D中简要补画出CO2的收集装置图。_____
(3)取12.5g石灰石于装置A中,向其中加入100g足量的稀盐酸,充分反应后(杂质不参加反应)的质量为108.1g,请计算:
①反应生成二氧化碳气体的质量为_____g;
②充分反应后,A装置内的混合物中含有氯化钙的质量为_____g;
③该石灰石中碳酸钙的质量分数为_____。
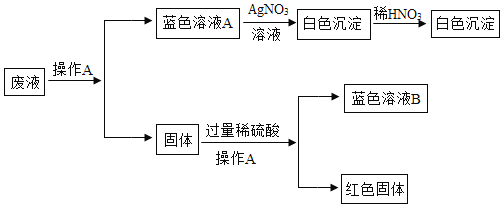
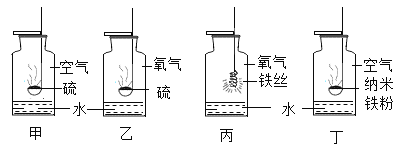
(4)反应后所得溶液中的溶质成分是什么?
猜想一:CaCl2; 猜想二:CaCl2和HCl。
①可选择下列物质中的_____(填字母)进行验证。
A 镁条 B 铜片 C 酚酞试液 D 硫酸溶液 E 硝酸银溶液 F 碳酸钙粉末
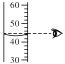
②实验后确认猜想二正确。取适量上述反应后所得滤液,逐滴滴入碳酸钠溶液,并用pH传感器连续监测,得到如图3曲线(纵坐标为pH,横坐标为时间):据图分析,写出BC段内发生的化学反应方程式为_____;图中CD段上升的原因是_____。
【题目】下表为元素周期表中某一周期元素的原子结构示意图。请回答下列问题:
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
(1)镁原子的核电荷数是____ 。
(2)氯原子在化学反应中容易_____ (填“得到”或“失去”)电子。
(3)从原子结构角度分析,上述元素位于同一周期的原因是____ 。