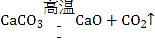题目内容
【题目】金属﹣工业的脊梁。金属及合金广泛应用于生活、生产和航天军工。
资料:水圈和岩石圈中含有丰富的镁元素。工业生产中,可用菱镁矿做原科制备金属镁,流程如图所示:
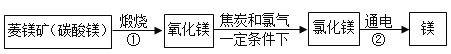
请回答下列问题:
(1)已知①和②属于分解反应,写出②的化学方程式_____。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备很多其他金属,请举一例说明_____(用化学方程式表示其制备原理)。
(3)如图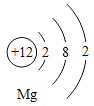 是镁原子结构示意图,镁化学性质活泼,原因是
是镁原子结构示意图,镁化学性质活泼,原因是
【答案】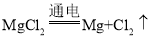
 最外层电子数小于4,易失去最外层的电子 ①③⑤
最外层电子数小于4,易失去最外层的电子 ①③⑤
【解析】
(l)②是电解氯化镁生成镁和氯气,化学方程式为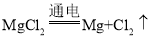 。
。
(2)通过化学反应,以岩石圈的矿石为原料还可以制备铁,化学方程式为,故填: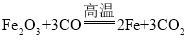 。
。
(3)根据图2镁原子结构示意图可以看出,镁原子的最外层电子为2,小于4,易失去电子,故镁化学性质活泼。硫酸铜、硫酸和氧气能和铁反应,故填:易失去最外层的电子;①③⑤。

【题目】下列除杂所选用试制与操作方法均正确的是
选项 | 物质 | 除杂试剂及操作 |
A |
| 加水溶解、过滤、蒸发结晶 |
B |
| 加入过量稀盐酸,蒸发结晶 |
C |
| 加入过量 |
D |
| 通入灼热的CuO |
A.AB.BC.CD.D
【题目】探究二、研究二氧化碳的制取

(1)同学们按表进行实验,取等质量的石灰石分别加入两种不同的酸(杂质不与酸反应)进行三次实验,产生二氧化碳体积随时间变化曲线如图1所示。
实验编号 | 药品 |
Ⅰ | 块状大理石、10%稀硫酸溶液 |
Ⅱ | 块状大理石、7%稀盐酸溶液 |
Ⅲ | 大理石粉末、7%稀盐酸溶液 |
①图中丙曲线对应实验_____(选填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②小组同学讨论确定用图中乙曲线对应的药品制备二氧化碳,反应方程式为_____。
③不用图1中甲曲线对应的药品,理由是_____。
(2)在实验室同学们选用图2装置制取比较纯净、干燥的CO2。
①B装置中发生反应的化学方程式为_____;
②C装置中浓硫酸的作用是_____;
③请在D中简要补画出CO2的收集装置图。_____
(3)取12.5g石灰石于装置A中,向其中加入100g足量的稀盐酸,充分反应后(杂质不参加反应)的质量为108.1g,请计算:
①反应生成二氧化碳气体的质量为_____g;
②充分反应后,A装置内的混合物中含有氯化钙的质量为_____g;
③该石灰石中碳酸钙的质量分数为_____。
(4)反应后所得溶液中的溶质成分是什么?
猜想一:CaCl2; 猜想二:CaCl2和HCl。
①可选择下列物质中的_____(填字母)进行验证。
A 镁条 B 铜片 C 酚酞试液 D 硫酸溶液 E 硝酸银溶液 F 碳酸钙粉末
②实验后确认猜想二正确。取适量上述反应后所得滤液,逐滴滴入碳酸钠溶液,并用pH传感器连续监测,得到如图3曲线(纵坐标为pH,横坐标为时间):据图分析,写出BC段内发生的化学反应方程式为_____;图中CD段上升的原因是_____。