题目内容
【题目】某化学兴趣小组对某铜锌合金样品进行探究实验。称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示。求:
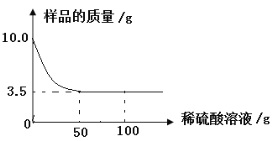
(1)铜锌合金汇中,Zn的质量分数是 。
(2)所用稀硫酸溶液中溶质的质量分数是多少?
【答案】(1)65%(2)19.6%
【解析】
试题分析:(1)根据图示可知,3.5克为合金中的铜,则锌的质量=10克-3.5克=6.5克,合金中锌的质量分数=6.5克/10克×100%=65%;
(2)根据锌的质量,利用化学方程式进行计算即可。具体如下:
解:设反应中消耗稀硫酸溶液中溶质的质量为X,
Zn + H2SO4 === ZnSO4 + H2 ↑
65 98
6.5g X
![]()
解得:X = 9.8g
所以,所用稀硫酸溶液中溶质的质量分数为:![]()

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目