题目内容
某化学兴趣小组为了测定黄铜(铜、锌合金)中锌的质量分数,取出6g合金样品,将50g稀硫酸分5次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | 4.7g |
| 第二次加入10g | mg |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.2g |
| 第五次加入10g | 1.2g |
(2)求合金中锌的质量分数?
(3)求稀硫酸中溶质的质量分数?
【答案】分析:可以根据表中的信息进行分析、判断,从而得出正确的结论.
解答:解:(1)由表中信息可知,10克稀硫酸能和1.3克锌反应,加入20克稀硫酸时,剩余固体的质量为:4.7g-1.3g=3.4g;
(2)当加入40克稀硫酸时,锌完全反应.铜的质量为1.2g,合金中锌的质量分数为 =80%.
=80%.
(3)因前三次中稀硫酸完全反应,故求稀硫酸溶质的质量分数,可用前三次的数据.
设10克稀硫酸中含硫酸的质量为x
Zn+H2SO4 =ZnSO4+H2↑
65 98
1.3g x
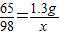
x=1.96g
则稀硫酸中溶质的质量分数为: ×100%=19.6%
×100%=19.6%
答:稀硫酸中溶质的质量分数是19.6%
故答案为:
(1)3.4g;(2)80%;(3)19.6%.
点评:表格题关键是能够通过图中所给的数据,分析出完全反应的点,同时由表格中的数据得到想要的信息,学会分析表格是关键.
解答:解:(1)由表中信息可知,10克稀硫酸能和1.3克锌反应,加入20克稀硫酸时,剩余固体的质量为:4.7g-1.3g=3.4g;
(2)当加入40克稀硫酸时,锌完全反应.铜的质量为1.2g,合金中锌的质量分数为
 =80%.
=80%.(3)因前三次中稀硫酸完全反应,故求稀硫酸溶质的质量分数,可用前三次的数据.
设10克稀硫酸中含硫酸的质量为x
Zn+H2SO4 =ZnSO4+H2↑
65 98
1.3g x
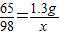
x=1.96g
则稀硫酸中溶质的质量分数为:
 ×100%=19.6%
×100%=19.6%答:稀硫酸中溶质的质量分数是19.6%
故答案为:
(1)3.4g;(2)80%;(3)19.6%.
点评:表格题关键是能够通过图中所给的数据,分析出完全反应的点,同时由表格中的数据得到想要的信息,学会分析表格是关键.

练习册系列答案
相关题目
某化学兴趣小组为了分析生铁中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:
(说明:生铁中杂质不溶于水,也不与硫酸反应.)
(1)第2次测得剩余固体质量为15.2g,其成分为 .
A.铁 B.铁和碳 C.碳
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
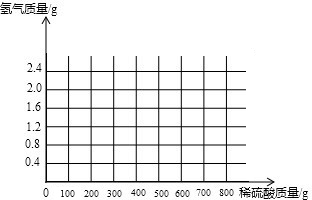
(3)计算所用稀硫酸的溶质质量分数为多少?(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 200 | 200 | 200 | 200 |
| 剩余固体质量(g) | 37.6 | 15.2 | 4 | 4 |

(说明:生铁中杂质不溶于水,也不与硫酸反应.)
(1)第2次测得剩余固体质量为15.2g,其成分为
A.铁 B.铁和碳 C.碳
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)计算所用稀硫酸的溶质质量分数为多少?(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
我市某地盛产石灰石,其中含有不溶于盐酸的杂质.某化学兴趣小组为了测定石灰石中碳酸钙的含量,取10.0g石灰石样品,经粉碎后全部放入烧杯中,并加入足量的稀盐酸,烧杯及所盛物质的总质量为80.0g.反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:
试计算:(1)反应结束后,共放出多少克的二氧化碳?
(2)该石灰石样品中碳酸钙的质量分数是多少?
| 反应时间/分 | 0 | 2 | 4 | 6 | 8 | 10 |
| 烧杯及所盛物质质量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
(2)该石灰石样品中碳酸钙的质量分数是多少?
 某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验.实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止.测得反应前后的有关质量如表:
某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验.实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止.测得反应前后的有关质量如表: