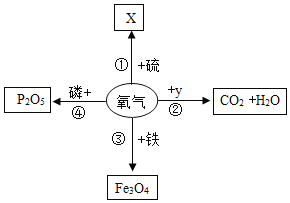
题目内容
【题目】某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。
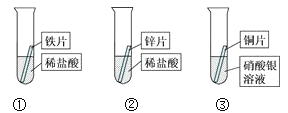
(1)通过观察,甲同学很快判断锌的活动性比铁强,甲同学依据的实验现象是________
(2)③中反应的化学方程式是_______
(3)乙同学认为上述实验不足以得出四种金属的活动性顺序,需再补充一个实验操作是________.
【答案】锌片表面比铁片表面产生的气泡快 Cu+2AgNO3═Cu(NO3)2+2Ag 将铁片投入到硫酸铜溶液中
【解析】
(1)由金属活动性顺序的特点可知,金属的活动性越强,金属与酸反应生成氢气的速度也快,故填锌片表面比铁片表面产生的气泡快。
(2)③中反应是铜和硝酸银反应生成硝酸铜和银,故反应的化学方程式写为:Cu+2AgNO3=Cu(NO3)2+2Ag。
(3)实验①②能证明锌的活动性比铁强,实验③能证明铜的活动性比银强,上述实验还不能证明铁的活动性比铜强,应该再增加一个证明铁的活动性比铜强的实验,该实验是:将铁片投入到硫酸铜溶液中,观察到铁片表面出现红色物质,故填将铁片投入到硫酸铜溶液中。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目