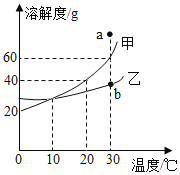
题目内容
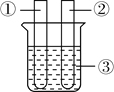
【题目】如下图是微型实验的装置图.
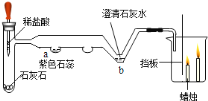
(1)由烧杯中出现的现象可说明二氧化碳具有什么性质_______?
(2)写出b处发生反应的化学方程式_______.
(3)采用微型实验装置有哪些优点_______?(答出一条即可)
【答案】二氧化碳密度比空气大,不能燃烧,不支持燃烧 Ca(OH)2+CO2═CaCO3↓+H2O 节约药品
【解析】
(1)烧杯中看到的现象是低层蜡烛先灭,高层的蜡烛后灭,说明二氧化碳密度比空气大,不能燃烧,不支持燃烧,故填二氧化碳密度比空气大,不能燃烧,不支持燃烧。
(2)b处发生的反应是氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,故反应的化学方程式写为:Ca(OH)2+CO2=CaCO3↓+H2O。
(3)采用微型实验装置是使用少量的药品得到同样的实验效果,故填节约药品。

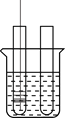
【题目】小李同学设计下表所示实验,探究金属铜对H2O2分解速率的影响.
操作 | 装置 | 现象 |
(1)取一个铜丝网,卷成筒形,固定在铁丝上. |
| |
(2)分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
(3)把铜丝网(连同固定的铁丝)插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(1)仪器②中实验的目的是________。
(2)能否得出铜可以加快H2O2分解速率的结论________(填“是”或“否”)。
(3)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是________。
A.称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B.向仪器②中加入二氧化锰
C.将实验后的铜丝网进行加热
D.将铁丝换成铜丝
E.将过氧化氢溶液加水稀释
(4)实验后确定铜可以加快H2O2分解的速率,请写出该反应的化学式表达式_______________。