题目内容
【题目】(1)用化学用语填空:
①食盐溶液中的阳离子_______; ②要产生舞台雾景可用______;
③含氧量最高的氧化物_______; ④预防贫血可补充_____元素。
(2)“酒精检测仪”可检查司机是否酒后驾车,其反应原理为:
C2H5OH + 4CrO3 + 6H2SO42Cr2(SO4)3 + 2X↑ + 9H2O,反应中红色的CrO3转变为绿色的Cr2(SO4)3,其中X的化学式为_____。
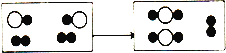
(3)下图为某化学反应的微观模拟图,“![]() ”分别表示两种质子数不同的原子。由“
”分别表示两种质子数不同的原子。由“![]() ”聚集成的物质______(选填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数比为______。
”聚集成的物质______(选填“可能”或“不可能”)是氧化物,参加反应的两种反应物的分子个数比为______。
(4)现有如下物质 ①液氧;②洁净的空气;③高锰酸钾;④冰水混合物;⑤水银;⑥过氧化氢; ⑦硬水。属于混合物的是________(填序号),属于化合物的是______(填序号);由原子构成的物质是_________(填化学式),
(5)化学反应前后,一定不变的是_____________(选填序号)。
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质种类
【答案】Na+ CO2 H2O2 Fe CO2 可能 2:1或1:2 ②⑦ ③④⑥ Hg ①②⑤
【解析】
(1)
①食盐是氯化钠的俗称,食盐中的阳离子就是钠离子,故填Na+;
②干冰升华能吸收大量的热,可用于舞台制造云雾缭绕的景象,故填CO2;
③含氧量最高的氧化物是过氧化氢,故填H2O2;
④贫血主要是指缺铁性贫血,可以补充铁元素预防,故填Fe;
(2)根据化学方程式可知,反应前的原子种类和数目分别是:2个碳原子、4个铬原子、6个硫原子、18个氢原子、37个氧原子,反应后有4个铬原子、6个硫原子、18个氢原子、33个氧原子和2X,根据质量守恒定律可知反应后还差的2个碳原子和4个氧原子需要由2个X分子提供,所以每个X含有1个碳原子和2个氧原子,故填CO2;
(3)氧化物是由两种元素组成且有一种是氧元素,故填可能;由图可知参加反应的两种物质微粒数,分别是:![]() 有2个,
有2个,![]() 有1个,还有1个
有1个,还有1个![]() 没参加反应,所以参加反应的两种物质的微粒个数比可以为2:1(
没参加反应,所以参加反应的两种物质的微粒个数比可以为2:1(![]() 和
和![]() 的比)或1:2(
的比)或1:2(![]() 和
和![]() 的比),故填2:1或1:2;
的比),故填2:1或1:2;
(4)液氧是液态氧气(O2),属于纯净物中的单质,空气是混合物,高锰酸钾(KMnO4)有固定组成且由三种元素组成,属于纯净物中的化合物,冰水混合物是纯净物,只含有H2O一种物质,属于化合物中的氧化物,水银(Hg)是液态金属,由原子直接构成物质,属于纯净物中的单质,过氧化氢(H2O2)有固定组成且有两种元素组成,属于纯净物中的化合物,硬水中含有较多的可溶性的钙、镁化合物,属于混合物,属于混合物的故填②⑦,属于化合物的故填③④⑥,由原子构成的物质故填Hg;
(5)根据质量守恒定律可知,在化学反应前后一定不变的有原子的种类、数目、质量,元素的种类、质量,还有物质的总质量,一定改变的有物质的种类、分子的种类,可能改变的有分子的数目、元素的化合价,故填①②⑤。

【题目】在老师的指导下,同学们进行了有趣的化学实验探究:
一、测定空气中氧气含量
图1所示的是小亮同学用红磷在空气中燃烧的测定方法.过程是:
第1步:将集气瓶容积划分为五等份,并做好标记.
第2步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第3步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5.请回答下列问题:
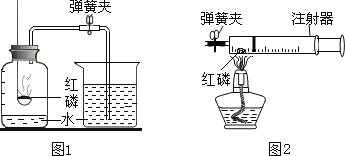
①第2步红磷燃烧时的现象_______________,化学反应表达式____________
②实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是_________.
A、集气瓶底部的水占了一部分体积
B、红磷过少
C、红磷没有燃烧完就急着打开了止水夹
③小博同学对实验进行反思后,提出了改进方法(如图2所示),小博在正式开始实验前,夹紧弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到活塞返回至20mL刻度处.该操作的主要目的是_________,你认为改进后的优点是_________
二、小余阅读课外资料得知:双氧水分解除了用二氧化锰(MnO2)还可用氧化铜(CuO)等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小余以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | CuO 0.5g | |
③ | 1.2g | MnO20.5g |
①上述实验应测 量的“待测数据”是时间__________.
②若实验②比实验①的“待测数据”_________(填“大”或“小”),说明氧化铜能加快氯酸钾的分解.
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g黑色粉末,这样做的目的是________,小余同学认为氧化铜肯定是氯酸钾分解的催化剂,但小淳同学对此提出了异议,小淳同学设计了如下实验:将第二次精确称量得到的0.5g黑色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃.小淳同学这样做目的是________,
(预期结论)氧化铜也能作氯酸钾的催化剂.
(评价设计)你认为小余设计实验③和实验②对比的目的是__________; 写出实验②反应的表达式______
【题目】小李同学设计下表所示实验,探究金属铜对H2O2分解速率的影响.
操作 | 装置 | 现象 |
(1)取一个铜丝网,卷成筒形,固定在铁丝上. |
| |
(2)分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
(3)把铜丝网(连同固定的铁丝)插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(1)仪器②中实验的目的是________。
(2)能否得出铜可以加快H2O2分解速率的结论________(填“是”或“否”)。
(3)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是________。
A.称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B.向仪器②中加入二氧化锰
C.将实验后的铜丝网进行加热
D.将铁丝换成铜丝
E.将过氧化氢溶液加水稀释
(4)实验后确定铜可以加快H2O2分解的速率,请写出该反应的化学式表达式_______________。