题目内容
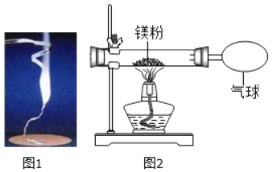
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,你认为出现这样实验结果的原因可能是_____。
(2)讨论后,同学们按如图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体:②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想:
实验操作 | 实验现象 | 实验结论 |
_____ | _____ | 黄色固体是Mg3N2 |
(反思与交流)
①氮化镁中氮元素的化合价是_____。
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。
③计算:36g镁条在空气中完全燃烧,所得固体中氧化镁的质量最多不到_____克。(写出计算过程)
【答案】反应生成的氧化镁部分扩散到空气中 取适量黄色固体样品于试管中,向试管中加入适量水,在试管口放湿润的红色石蕊试纸 湿润的红色石蕊试纸变蓝色 ﹣3 相同条件下,氧气比氮气更容易和镁反应 15g
【解析】
(1)在石棉网上收集到产物的质量小于镁条的质量,出现这样实验结果的原因可能是反应生成的氧化镁部分扩散到空气中;
(2)[实验探究]
实验过程如下表所示:
实验操作 | 实验现象 | 实验结论 |
取适量黄色固体样品于试管中,向试管中加入适量水,在试管口放湿润的红色石蕊试纸 | 湿润的红色石蕊试纸变蓝色 | 黄色固体是Mg3N2 |
[反思与交流]
①氮化镁中,镁元素化合价是+2,根据化合物中元素化合价代数和为零可知,氮化镁中氮元素的化合价是﹣3;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:相同条件下,氧气比氮气更容易和镁反应;
③空气中氧含量约21%,氮气含量约78%,氧气与氮气比约为1:4,所以可以认为有四分之一的镁会与氧气反应,
设所得固体中氧化镁的质量最多为x:
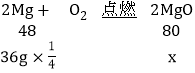
![]()
x=15g