题目内容
【题目】根据实验室制取气体的常用装置图,回答问题:

(1)图中①仪器名称是______________。
(2)用A装置制取氧气的化学方程式:_________。
(3)实验室既可制取二氧化碳,又可制取氧气的发生装置______(填装置字母),用该装置制取二氧化碳的化学方程式为:______________。
(4)若用F装置收集二氧化碳,验满时把燃着的木条放在玻璃导管的______(选填“a”或“b”,下同)端,若木条熄灭,则已收集满;若F装置装满水,收集氧气,则气体从F装置的______端通入;若F装置中盛有浓H2SO4,则不能干燥______(填序号)。
①氨气 ②氢气 ③氧气 ④二氧化碳
【答案】锥形瓶 2KClO3![]() 2KCl + 3O2↑ B CaCO3+2HCl═CaCl2+H2O+CO2↑ b; b; ①;
2KCl + 3O2↑ B CaCO3+2HCl═CaCl2+H2O+CO2↑ b; b; ①;
【解析】
(1)锥形瓶是常用的反应容器,故答案为:锥形瓶;
(2)A装置的试管中没有棉花团,则是加热氯酸钾制氧气,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,装置属于固液常温型,故选B,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)若用F装置收集二氧化碳,a是进气管,b是出气管,验满时把燃着的木条放在玻璃导管的b端,若木条熄灭,则已集满;若F装置装满水,收集氧气,因为氧气的密度比水小,氧气从F装置的短管b进入;氨气能与浓硫酸反应,不能用浓硫酸干燥。

【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图1),同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
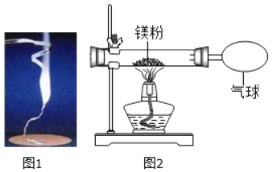
(1)通过称量发现:在石棉网上收集到产物的质量小于镁条的质量,你认为出现这样实验结果的原因可能是_____。
(2)讨论后,同学们按如图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
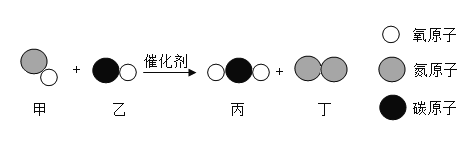
(查阅资料)①氧化镁为白色固体:②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想:
实验操作 | 实验现象 | 实验结论 |
_____ | _____ | 黄色固体是Mg3N2 |
(反思与交流)
①氮化镁中氮元素的化合价是_____。
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。
③计算:36g镁条在空气中完全燃烧,所得固体中氧化镁的质量最多不到_____克。(写出计算过程)