题目内容
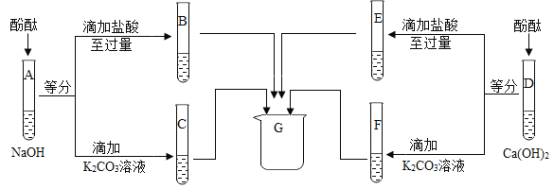
【题目】某化学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
(知识卡片):氯化钠溶液显中性。氯化铜易溶于水。
(实验探究):
(1)方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论_________。
②从微观的角度分析,该反应的实质是_________。
③在滴入稀盐酸的过程中,若观察到有少量气泡出现,请分析产生气泡的可能原因_______(用化学方程式表示)。
(2)方案Ⅱ:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 | 若_______ | 稀盐酸过量 |
若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
(实验反思):
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完全反应”_________ (填序号)。
A 铜片 B pH试纸 C 氧化铜 D 紫色石蕊试液
【答案】证明 NaOH 溶液与稀盐酸恰好完全反应 H+和OH-反应生成H2O分子 2NaOH+CO2=Na2CO3+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O 有气泡产生 稀盐酸量不足的情况下,也无明显现象 B、D
【解析】
(1)①酚酞遇碱性溶液变红,遇中性或酸性溶液不变色,滴入几滴酚酞溶液,溶液变红,然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色,证明 NaOH 溶液与 稀盐酸恰好完全反应;
②从微观的角度分析,中和反应实质是氢离子和氢氧根离子生成水;
③当与盐酸反应时有气泡,气泡很可能是CO2,氢氧化钠可能变质,NaOH与空气中CO2反应生成碳酸钠,产生气泡的可能原因是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应方程式是:![]() ,
,![]() ;
;
(2)取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条,若有气泡产生,则稀盐酸过量,因为稀盐酸与镁反应生成氯化镁和氢气;若没有明显现象,则NaOH溶液与稀盐酸恰好完全反应;
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是稀盐酸量不足的情况下,也无明显现象;
(4)A 铜与稀盐酸不反应,不能检验;
B 用pH 试纸测定溶液的酸碱度,若pH=7,则恰好反应,若pH<7,酸有剩余,pH>7,碱剩余;C 氧化铜与盐酸反应生成蓝色氯化铜溶液和水,但是只能证明酸过量,不能证明恰好反应,因为酸不足或者酸量正好均无明显现象;
D 滴入石蕊试液,石蕊试液变红,说明盐酸过量,石蕊试液变蓝,证明酸不足,如果石蕊试液不变红,说明盐酸恰好完全反应;
故选:BD。

【题目】兴趣小组的同学学习了碳酸钠的性质后,对碳酸氢钠的性质也进行探究。
(问题1)碳酸氢钠溶液与碳酸钠溶液的酸碱性
(实验1)用pH试纸测定等浓度的碳酸氢钠和碳酸钠溶液的pH,分别为9和12;
(结论1)两种溶液都呈碱性,它们的碱性强弱顺序为_____。
(问题2)碳酸氢钠溶液、碳酸钠溶液与酸的反应
(实验2)等浓度的碳酸氢钠和碳酸钠溶液分别与相同浓度的盐酸反应,操作和现象如下表:
序号 | 操作 | 现象 |
实验① | 碳酸氢钠溶液逐滴加入盐酸中 | 立刻产生气泡 |
实验② | 碳酸钠溶液逐滴加入盐酸中 | 立刻产生气泡 |
实验③ | 盐酸逐滴加入碳酸氢钠溶液中 | 立刻产生气泡 |
实验④ | 盐酸逐滴加入中碳酸钠溶液中 | 滴加一会后才有气泡产生 |
(问题3)实验④与另外三个实验现象不同的原因
(实验3)将等浓度的碳酸氢钠和碳酸钠溶液与相同浓度的盐酸互滴,利用手持传感器测定反应中溶液pH变化,四个实验的pH变化与时间的关系如图所示。
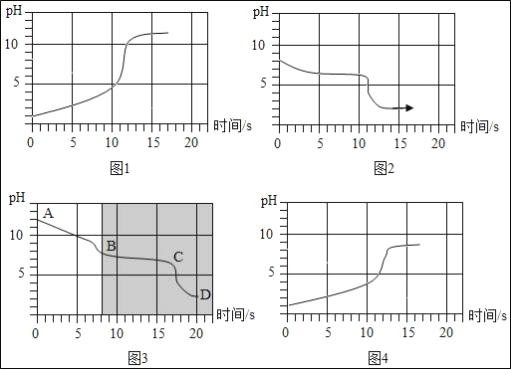
(解析)(分析)
(1)图4表示的实验是实验_____(填实验2中的序号)。
(2)比较图3与图2发现:图3中的阴影部分与图2叠合后,图象基本重合。则图3中的AB段发生反应的化学方程式为_____,BC段发生反应的化学方程式为_____,D点的溶质为_____(写化学式);所以,“盐酸逐滴加入碳酸钠溶液中,滴加一会后才有气泡产生”的原因是盐酸先和碳酸钠反应生成碳酸氢钠和氯化钠,后和碳酸氢钠反应生成氯化钠、_____。
(注意:正确回答下列问题加4分,总分不超过60分)
(3)比较图1与图3发现:不同的操作有不同现象,试分析造成这一现象的原因:_____。
(应用)用稀盐酸来鉴别一瓶溶液是氢氧化钠还是碳酸钠时,应如何操作?_____。