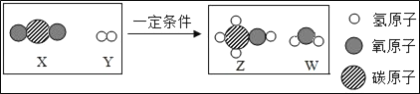
题目内容
【题目】水和溶液在生命活动和生产、生活中起着十分重要的作用.
(1)净水器中经常使用活性炭,活性炭的用途_____
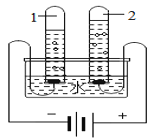
(2)如图实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为_____mL;
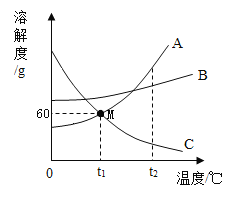
(3)①图中P点的含义是_____
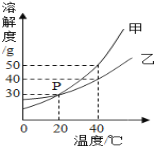
②乙的饱和溶液中含有少量的甲,若要提纯乙,采用_____法
③20℃时,将30g乙物质放入50g水中,求所得溶液中溶质的质量分数_____.
④气体的溶解度常用体积来表示,如![]() 时,氮气的溶解度为
时,氮气的溶解度为![]() ,其含义是_____.
,其含义是_____.
【答案】吸附水中的色素和异味 3 20℃时,甲、乙两种物质的溶解度均为30g 蒸发结晶 23.1% 0℃时,1体积的水中,最多溶解0.024体积的氮气
【解析】
(1)活性炭具有吸附性,能够吸附水中的色素和异味,起净水作用,故填吸附水中的色素和异味。
(2)由图可知,试管1连接电源的负极,试管内的气体为氢气,当其体积为6mL时,则试管2中气体体积约为3mL,故填3。
(3)①由图可知,20℃时,甲、乙两种物质的溶解度曲线相交于P点,则P点的含义是20℃时,甲、乙两种物质的溶解度均为30g,故填20℃时,甲、乙两种物质的溶解度均为30g。
②由图可知,甲、乙两种物质的溶解度均随温度升高而增大,甲的溶解度受温度影响较大,而乙的溶解度受温度影响较小,所以提纯乙需要采用蒸发结晶的方法,故填蒸发结晶;
③由图可知,20℃时,乙的溶解度为30g,则此时将30g乙物质放入50g水中只有15g乙能溶解,形成饱和溶液的质量为65g,溶液中溶质的质量分数为![]() ×100%≈23.1%,故填23.1%;
×100%≈23.1%,故填23.1%;
④气体的溶解度常用体积来表示,如0℃时,氮气的溶解度为0.024,其含义是0℃时,1体积的水中,最多溶解0.024体积的氮气,故填0℃时,1体积的水中,最多溶解0.024体积的氮气。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】某化学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
(知识卡片):氯化钠溶液显中性。氯化铜易溶于水。
(实验探究):
(1)方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变红。然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
①实验结论_________。
②从微观的角度分析,该反应的实质是_________。
③在滴入稀盐酸的过程中,若观察到有少量气泡出现,请分析产生气泡的可能原因_______(用化学方程式表示)。
(2)方案Ⅱ:
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 | 若_______ | 稀盐酸过量 |
若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
(实验反思):
(3)另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是______。
(4)除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完全反应”_________ (填序号)。
A 铜片 B pH试纸 C 氧化铜 D 紫色石蕊试液
【题目】现有铜与金属X组成的混合物粉末,金属X是镁、铁、锌中的一种.利用该混合物进行如下实验:
实验步骤及数据:取该混合物粉末8.0g放入烧杯中,将140.0g 溶质质量分数为14.0%的稀硫酸平均分四次加入该烧杯中,充分反应后,测得烧杯内剩余固体的质量数据如下表:
加入稀硫酸的次数 | 第1次 | 第2次 | 第3次 | 第4次 |
烧杯内剩余固体质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
实验通过计算,求:
(1)该混合物粉末中铜的质量分数为_____;
(2)该混合物是由铜粉和_____组成的;
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?_____(写出计算过程)
(4)若用溶质的质量分数为98%、密度为1.84g/cm﹣3的浓硫酸来配制本实验中所用的稀硫酸,则需要取浓硫酸多少毫升?_____同时加入水多少毫升?_____(写出计算过程)