题目内容
【题目】兴趣小组的同学通过实验探究热水壶底部水垢的主要成分。
(提出问题)硬水煮沸后的白色固体(水垢)中含有什么物质?
(查阅资料)
Ⅰ.硬水中含有一定量的 Ca(HCO3)2 和 Mg(HCO3)2,加热时趋于生成溶解度更小的物质。 有关物质的溶解性:
物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
Ⅱ. Mg(OH)2 和 MgCO3 受热分解均分别生成对应的两种氧化物。
(猜想)水垢的主要成分一定含有不溶的Mg(OH)2 和________,可能含有微溶的Ca(OH)2和______。
(实验)
(1)初步探究白色固体成分
①甲同学取白色固体少许,加入适量水充分溶解,在上层清液中滴加________溶液(选 填序号),没有白色沉淀生成,说明水垢中无 Ca(OH)2;
A 碳酸钠 B 氯化钾 C 碳酸钾
②另取白色固体加入稀盐酸,观察到有气泡产生,甲同学认为还含有 MgCO3,其他同学否定了他的结论,理由是__________。
③已知Ca(HCO3)2 受热分解与碳酸氢钠受热分解类似,请写出Ca(HCO3)2 受热分解的化学方程式___________________。
(2)为进一步确定白色固体的成分,乙同学称取 20g 白色固体,设计如下实验:

碱石灰的主要成分是固体 CaO 和 NaOH 的混合物。
①反应前,先通一段时间的空气,目的是______________。
②实验中 E 装置的作用是____________________。
③充分反应后,测得 C 增重 1.8g,D 中增重 6.6g。20g 白色固体中 Mg(OH)2 的质量是___________________g。
(结论)该白色固体中氢氧化镁与碳酸钙的质量比为_________。
【答案】CaCO3 MgCO3 AC 碳酸钙与稀盐酸反应也产生气泡 ![]() 排尽装置内空气中的二氧化碳和水,减少误差 防止外界空气中的二氧化碳和水进入D中,减少误差 5.8 58:100(或29:50)
排尽装置内空气中的二氧化碳和水,减少误差 防止外界空气中的二氧化碳和水进入D中,减少误差 5.8 58:100(或29:50)
【解析】
[猜想]:通过表格可知,不溶物为氢氧化镁和碳酸钙,微溶无为碳酸镁和氢氧化钙。则可以分析出水垢中一定含有不溶的氢氧化镁和碳酸钙,可能含有微溶的氢氧化钙和碳酸镁。故答案为:CaCO3、MgCO3;
(1)①甲同学取白色固体少许,加入适量的水充分溶解,在上层清液中滴加碳酸钾或碳酸钠溶液,没有白色沉淀生成,证明没有氢氧化钙。因为氢氧化钙中的钙离子会和碳酸钾或碳酸钠中的碳酸根离子结合,生成碳酸钙沉淀。所以通过此实验可以证明出,白色固体不含氢氧化钙。故答案为:A或C;
②通过猜想可知,粉末中一定含有碳酸钙,可能含有碳酸镁。加入的稀盐酸会和碳酸钙、碳酸镁都会反应生成二氧化碳,有气体产生,所以无法证明一定含有碳酸镁。因为若不含有碳酸镁,也能观察到同样的现象。故答案为:碳酸钙与稀盐酸反应也产生气泡;
③碳酸氢钠受热分解为碳酸钠、水和二氧化碳。则碳酸氢钙受热也会分解为对应的碳酸盐,即碳酸钙、水和二氧化碳。故答案为:![]() ;
;
(2)通过实验信息可知,将固体物质加热,通过测定生成物的质量从而计算反应物的质量。根据题意可知,氢氧化镁受热分解的方程式为:![]() ,碳酸镁受热分解的方程式为:
,碳酸镁受热分解的方程式为:![]() ,碳酸钙受热分解的方程式为:
,碳酸钙受热分解的方程式为:![]() 。C装置中盛放的无水硫酸铜可以检测生成水的质量,D装置中的碱石灰可以检测生成的二氧化碳的质量。A、E装置中的碱石灰作用是吸收空气中的水分和二氧化碳,防止干扰实验。
。C装置中盛放的无水硫酸铜可以检测生成水的质量,D装置中的碱石灰可以检测生成的二氧化碳的质量。A、E装置中的碱石灰作用是吸收空气中的水分和二氧化碳,防止干扰实验。
①反应前,应该先通入一段时间的空气,目的是排尽装置内空气中的二氧化碳和水,避免对实验造成干扰,减小误差。故答案为:排尽装置内空气中的二氧化碳和水,减少误差;
②通过分析可知,实验需要通过测定D装置增加的重量从而推测固体的成分。若没有E装置,则空气中的水分和二氧化碳会进入实验装置中,从而影响实验的测定,造成误差。故答案为:防止外界空气中的二氧化碳和水进入D中,减少误差;
③充分反应后,测得C增重1.8g,则说明生成水的质量为1.8g。而三种物质中,只有氢氧化镁受热分解能生成水,则证明白色固体中含有氢氧化镁。D中增重6.6g,则说明生成二氧化碳的质量为6.6g,白色固体中含有碳酸盐。
设20g白色固体中,氢氧化镁的质量为x。
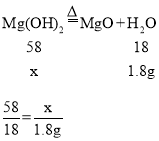
解得x=5.8g。故答案为:5.8;
[结论]:设碳酸钙生成二氧化碳的质量为a1,碳酸镁生成二氧化碳的质量为a2,碳酸钙质量为y,则碳酸镁的质量为(20g-5.8g-y)。

解得:y=![]() ……①
……①
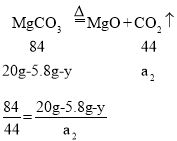
解得:14.2g-y=![]() ……②
……②
则联立①、②得:①+②:14.2g=![]() +
+![]() ……③
……③
由根据题意可知,共计生成二氧化碳的质量为6.6g,则a1+a2=6.6g……④
解得a1=4.4g,a2=2.2g。
所以混合物中,碳酸钙的质量为:![]() ,碳酸镁的质量为:20g-5.8g-10g=4.2g。
,碳酸镁的质量为:20g-5.8g-10g=4.2g。
所以白色固体中氢氧化镁与碳酸钙的质量比为:5.8g:10g=58:100=29:50。故答案为:58:100(或29:50)。

 阅读快车系列答案
阅读快车系列答案【题目】在宏观、微观和符号之间建立联系是化学学科学习的特点。
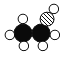
(1)甲、乙、丙、丁表示四种物质,它们的微观示意图如表所示:
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观示意图 |
|
|
|
|
①一个丙分子共有___________个原子。
②甲、乙、丙、丁四种物质中属于氧化物的是__________和____________(写化学式)。
(2)工业上使用一种国产低温催化剂生产氢气的反应过程如图所示:
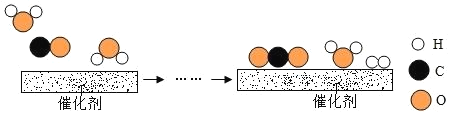
①该反应的化学方程式为_______________;
②参加反应的![]() 与
与![]() 分子个数之比为______________。
分子个数之比为______________。
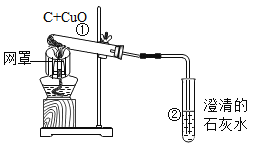
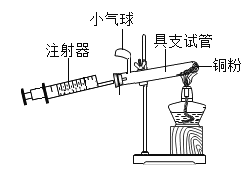
【题目】果果了解到:对意外伤害时进行紧急抢救,最宝贵时刻在于事发最初的黄金4分钟时间里,对病患者进行心肺复苏术急救,果果探究小组设计右图所示装置测定人体呼出气体中的氧气含量,请你共同完成探究过程:
(查阅资料)正常空气中氧气的体积分数为21%,人平常呼气中含氧量为16%,人工呼吸时可增至18%,而含二氧化碳仅为2%,因此呼气中的氧气浓度足以维持生命所需,可根据具体情形,可采用不同的人工呼吸法。
(实验方案)采用排水法收集人体呼出的气体,储存在由注射器和具支试管组成的密闭系统中,并在注射器内留有25mL空气,给装有铜粉的具支试管加热,同时缓慢推拉注射器活塞,待注射器活塞冷却并稳定后,观察密闭系统内空气体积变化:
(1)在实验加热过程中,具支试管上的小气球作用是______________;
(2)写出该实验中反应的化学方程式为______________________;
(归纳结论)果果测得实验结果如下:
反应前装置内气体总体积 | 反应后装置内气体总体积 |
25.0mL | 20.5mL |
(3)由此数据可以推算出:测定出人体呼出气体中氧气的体积分数为______,则不影响病患者的正常呼吸。
(4)如果该实验出现误差,所造成的原因可能是________(填序号)。
①没有推拉注射器活塞; ②读数时没有冷却至室温;
③加入铜粉量太少; ④加入铜粉量太多;
(反思拓展)(5)通过上面的实验,你学到的测定人体呼出气体中氧气含量的方法是______。