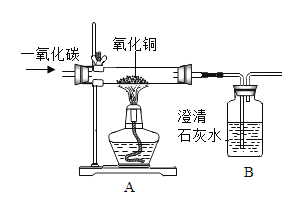
题目内容
【题目】FeSO4 可用于治疗缺铁性贫血症。已知铁元素在周期表中的相关信息及铁原子结构示意图如下所示;1 个碳 12 原子的质量约为 1.99×10 -26kg。下列说法中正确的是
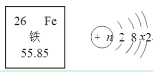
A.FeSO4 的名称为硫酸铁
B.FeSO4 中 S、O 元素的质量比为 1:4
C.n = 26,x = 18
D.1 个铁原子的质量约为 9.26×10 -26 kg
【答案】D
【解析】
根据化学式可求出其组成元素的质量比;由题目中的元素周期表中的铁元素及其原子结构示意图可知,其原子序数、元素种类、质子数、相对原子质量、得失电子情况等。
A、硫酸铁中铁显+3价,硫酸根显2价,其化学式为Fe2(SO4)3,选项中的铁为+2价,读作硫酸亚铁,故选项错误,不符合题意。
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,硫酸亚铁中硫、氧元素的质量比为32:(16×4)=1:2,故选项错误,不符合题意。
C、在原子中原子序数=质子数=核外电子数,由元素周期表信息可知铁的原子序数为26,故它的质子数为26,原子结构示意图中,圈内代表的是质子数,圈外的是电子数,因铁的原子序数是26,所以n=26,2+8+x+2=26,得x=14,故选项错误,不符合题意。
D、相对原子质量是一个原子的真实质量跟一个碳12原子质量的![]() 的比值,故1个铁原子的质量=
的比值,故1个铁原子的质量=![]() ≈9.26×10-26kg,选项正确,符合题意。
≈9.26×10-26kg,选项正确,符合题意。
故选:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】硫酸镁晶体(MgSO4﹒7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶于水、也不溶于酸的杂质)为原料制取硫酸镁晶体的流程如下:

已知:部分氢氧化物沉淀时溶液的pH见下表:
物质名称 | Mg(OH)2 | Fe(OH)3 |
开始沉淀 | 9.1 | 1.9 |
完全沉淀 | 11.1 | 3.2 |
(1)“浸取”步骤中,MgCO3 溶于稀硫酸的化学方程式为_______。
(2)“氧化”步骤中,加入H2O2溶液会生成Fe2(SO4)3和水,该反应的化学方程式是_____________。
(3)“沉淀”步骤中,用氨水调节溶液的pH范围为_______,其目的是________。
(4)“过滤”所得滤液中含有的阳离子为_________(写离子符号)。
(5)“结晶”步骤中需蒸发浓缩滤液,当蒸发皿中_______时 即可停止加热。
【题目】生铁和钢都是由铁和碳组成的合金,生铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~2%,为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示:
烧杯质量 | 样品的质量 | 稀盐酸的质量 | 烧杯+剩余物的总质量 |
50g | 5.8g | 94.6g | 150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
请根据相关信息完成下列计算:
(1)恰好完全反应时,生成氢气的质量为_____ g;
(2)样品中碳的质量分数_____(计算结果保留到0.1%);
【题目】下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生 成另一种物质.甲、乙、丙三种物质不符合对应“转化关系”的是( )
选项 | A | B | C | D | |
转化关系 |
|
|
|
| |
物质 | 甲 | H2SO4 | C | CaCO3 | FeCl2 |
乙 | H2 | CO | CO2 | Fe | |
丙 | H2O | CO2 | H2O | Fe2O3 | |
A. AB. BC. CD. D
【题目】兴趣小组的同学通过实验探究热水壶底部水垢的主要成分。
(提出问题)硬水煮沸后的白色固体(水垢)中含有什么物质?
(查阅资料)
Ⅰ.硬水中含有一定量的 Ca(HCO3)2 和 Mg(HCO3)2,加热时趋于生成溶解度更小的物质。 有关物质的溶解性:
物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
Ⅱ. Mg(OH)2 和 MgCO3 受热分解均分别生成对应的两种氧化物。
(猜想)水垢的主要成分一定含有不溶的Mg(OH)2 和________,可能含有微溶的Ca(OH)2和______。
(实验)
(1)初步探究白色固体成分
①甲同学取白色固体少许,加入适量水充分溶解,在上层清液中滴加________溶液(选 填序号),没有白色沉淀生成,说明水垢中无 Ca(OH)2;
A 碳酸钠 B 氯化钾 C 碳酸钾
②另取白色固体加入稀盐酸,观察到有气泡产生,甲同学认为还含有 MgCO3,其他同学否定了他的结论,理由是__________。
③已知Ca(HCO3)2 受热分解与碳酸氢钠受热分解类似,请写出Ca(HCO3)2 受热分解的化学方程式___________________。
(2)为进一步确定白色固体的成分,乙同学称取 20g 白色固体,设计如下实验:

碱石灰的主要成分是固体 CaO 和 NaOH 的混合物。
①反应前,先通一段时间的空气,目的是______________。
②实验中 E 装置的作用是____________________。
③充分反应后,测得 C 增重 1.8g,D 中增重 6.6g。20g 白色固体中 Mg(OH)2 的质量是___________________g。
(结论)该白色固体中氢氧化镁与碳酸钙的质量比为_________。