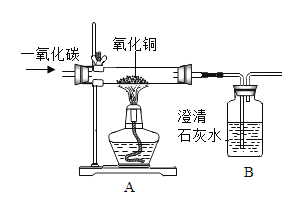
题目内容
【题目】现有 HCl 与 CaCl2 的混合溶液,为了分析混合溶液中 HCl 和 CaCl2 的质量分数, 设计了如下实验方案:
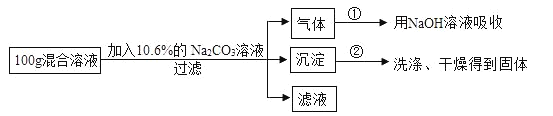
(实验数据)
实验共记录了两组数据:
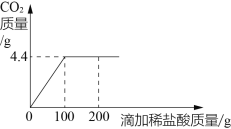
第①组,气体吸收完全后,NaOH 溶液质量增加 4.4g;
第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为 10g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液与碳酸钠溶液反应生成的 CO2 的质量为_______________g。
(2)混合溶液中 HCl 的质量分数为_____________?
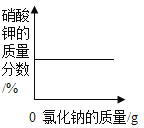
(3)若在 100g 混合溶液中不断加入10.6%的Na2CO3 的溶液,请你画出加入 Na2CO3 溶液的质量与产生沉淀的质量的关系图_____________。
【答案】4.4g 7.3% 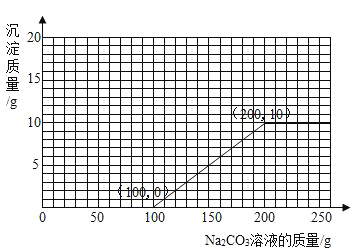
【解析】
(1)氢氧化钠溶液增加的质量即为碳酸钠和盐酸反应生成二氧化碳的质量,即为4.4g;故填:4.4;
(2)设混合溶液中含有氯化氢的质量为x,与盐酸反应的碳酸钠的质量为y
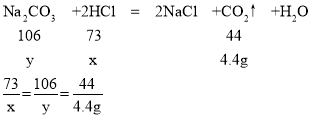
x=7.3g y=10.6g
所以混合溶液中HCl的质量分数为:![]()
答:混合溶液中HCl的质量分数为7.3%。
故填:7.3%;
(3)设混合溶液中CaCl2的质量为z,与氯化钙反应的碳酸钠的质量为a
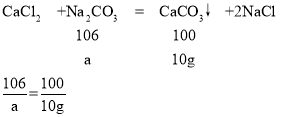
a=10.6g
根据题中所给物质的性质可以知道,在盐酸存在的情况下碳酸钙不可能以沉淀的形式析出,所以加入的碳酸钠要先和盐酸反应,
盐酸消耗碳酸钠溶液的质量为:10.6g÷10.6%=100g,
氯化钙消耗碳酸钠溶液的质量为:10.6g÷10.6%=100g
可以知道,盐酸消耗碳酸钠溶液的质量为100g,即当滴入100g碳酸钠溶液后才会产生沉淀,其中生成沉淀的质量为10g,此时一共消耗碳酸钠溶液的质量为100g+100g=200g,可以据此描点连线得出加入Na2CO3溶液的质量与产生沉淀的质量的关系图为: 。
。
故填: 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列各组转化关系中的反应为初中化学常见的反应,其中的“→”表示某种物质可一步反应生 成另一种物质.甲、乙、丙三种物质不符合对应“转化关系”的是( )
选项 | A | B | C | D | |
转化关系 |
|
|
|
| |
物质 | 甲 | H2SO4 | C | CaCO3 | FeCl2 |
乙 | H2 | CO | CO2 | Fe | |
丙 | H2O | CO2 | H2O | Fe2O3 | |
A. AB. BC. CD. D
【题目】兴趣小组的同学通过实验探究热水壶底部水垢的主要成分。
(提出问题)硬水煮沸后的白色固体(水垢)中含有什么物质?
(查阅资料)
Ⅰ.硬水中含有一定量的 Ca(HCO3)2 和 Mg(HCO3)2,加热时趋于生成溶解度更小的物质。 有关物质的溶解性:
物 质 | Ca(HCO3)2 | Mg(HCO3)2 | Ca(OH)2 | Mg(OH)2 | CaCO3 | MgCO3 |
溶解性 | 可溶 | 可溶 | 微溶 | 不溶 | 不溶 | 微溶 |
Ⅱ. Mg(OH)2 和 MgCO3 受热分解均分别生成对应的两种氧化物。
(猜想)水垢的主要成分一定含有不溶的Mg(OH)2 和________,可能含有微溶的Ca(OH)2和______。
(实验)
(1)初步探究白色固体成分
①甲同学取白色固体少许,加入适量水充分溶解,在上层清液中滴加________溶液(选 填序号),没有白色沉淀生成,说明水垢中无 Ca(OH)2;
A 碳酸钠 B 氯化钾 C 碳酸钾
②另取白色固体加入稀盐酸,观察到有气泡产生,甲同学认为还含有 MgCO3,其他同学否定了他的结论,理由是__________。
③已知Ca(HCO3)2 受热分解与碳酸氢钠受热分解类似,请写出Ca(HCO3)2 受热分解的化学方程式___________________。
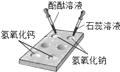
(2)为进一步确定白色固体的成分,乙同学称取 20g 白色固体,设计如下实验:

碱石灰的主要成分是固体 CaO 和 NaOH 的混合物。
①反应前,先通一段时间的空气,目的是______________。
②实验中 E 装置的作用是____________________。
③充分反应后,测得 C 增重 1.8g,D 中增重 6.6g。20g 白色固体中 Mg(OH)2 的质量是___________________g。
(结论)该白色固体中氢氧化镁与碳酸钙的质量比为_________。