��Ŀ����
����Ŀ����������ʵ��װ��ͼ���ش����⣺
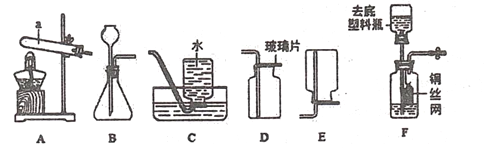
��1�������a������___________��
��2�����ȸ��������ȡ�������仯ѧ����ʽΪ_________________��ѡ�õ�װ�����Ϊ____________������ĸ����
��3���뼯��ƿ����ʹ�õIJ���Ƭһ��һ��Ϊ�⻬�棬��һ��Ϊĥɰ�棬�ռ�����ʱ�ò���Ƭ��__________����⻬�桱��ĥɰ�桱���Ǻü���ƿ��
��4��ʵ������ȡ������̼�Ļ�ѧ��Ӧ����ʽΪ___________��ͼF��ijͬѧ��������ƿ��������Ʒ��ƵĶ�����̼�ķ���װ�ã��������Bװ�ñȽϣ����˷������õ��ŵ��⣬����д��һ���ŵ�_______��
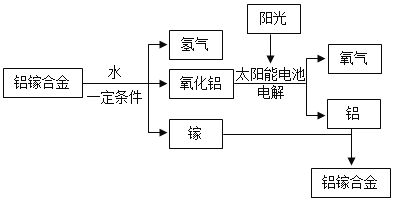
���𰸡��Թ� 2KMnO4![]() K2MnO4+MnO2+O2�� AC��AD ĥɰ�� CaCO3+2HC1=CaC12+CO2��+H2O �ܿ��Ʒ�Ӧ�ķ�����ֹͣ��
K2MnO4+MnO2+O2�� AC��AD ĥɰ�� CaCO3+2HC1=CaC12+CO2��+H2O �ܿ��Ʒ�Ӧ�ķ�����ֹͣ��
��������
��1������a ���������Թܡ�
��2����������ڼ��ȵ������·�Ӧ��������ء��������̺���������Ӧ�ķ���ʽΪ��2KMnO4![]() K2MnO4+MnO2+O2�����÷�Ӧ��ȡ�����ķ�Ӧ���״̬�ǹ�̬����Ӧ�������Ǽ��ȣ��ʷ���װ��ѡ�̹̼�����װ��A���������ܶȱȿ������ܶȴ�������ˮ�����ռ�װ�ÿ���ѡ��ˮ��װ��C�������ſ�����װ��D�������װ��Ϊ��AC��AD��
K2MnO4+MnO2+O2�����÷�Ӧ��ȡ�����ķ�Ӧ���״̬�ǹ�̬����Ӧ�������Ǽ��ȣ��ʷ���װ��ѡ�̹̼�����װ��A���������ܶȱȿ������ܶȴ�������ˮ�����ռ�װ�ÿ���ѡ��ˮ��װ��C�������ſ�����װ��D�������װ��Ϊ��AC��AD��
��3���ռ�����ʱ�ò���Ƭ��ĥɰƬ���ڼ���ƿ�ϡ�
��4��ʵ������̼��ƺ�ϡ���ᷴӦ��ȡ������̼����Ӧ�ķ���ʽΪ��CaCO3+2HC1=CaC12+CO2��+H2O���÷�Ӧ�е�ͭ�����Կ���̼���ܷ���ϡ����Ӵ����Ӷ����Կ��Ʒ�Ӧ�ķ�����ֹͣ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
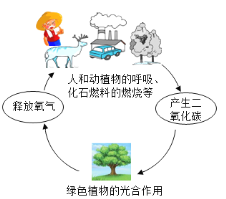
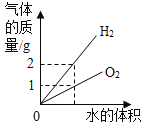
Сѧ��10����Ӧ����ϵ�д�����Ŀ������4������ͼ�ֱ�ʾ��ʵ�������ijЩ���ı仯��������ȷ����
|
|
|
|
A.��һ����ʯ��ʯ�еμ�ϡ���� | B.��ijһ�ܱ�װ���ڵ�ȼ���� | C.����һ����������ع��� | D.���ˮ������������������ |
A. AB. BC. CD. D
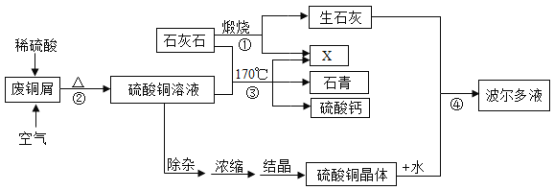
����Ŀ��ij��������ʯ��ʯ�ͷ�ͭм���������ʯ�ࡢ������Һ�Ĺ����������£�
һ����Ʒ�Ʊ�
��1������ͼ��X�Ļ�ѧʽΪ__________��
��2����Ӧ�ڵ��ܻ�ѧ����ʽΪ__________________________��
��3������ͭ���壨CuSO45H2O�����ܽ�����±���
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
�ܽ��/g | 14.3 | 17.4 | 20.7 | 25.0 | 28.5 | 33.3 | 40.0 | 55.0 | 75.4 |
����Ũ��������Һ�����������������壬�¶ȵ���30��ʱ��ʣ������ͭ��Һ��������������Ϊ_____�����ᾧ��Ϻ��˳����壬��������ˮϴ��2��3�Σ��ñ�ˮϴ�ӵ�Ŀ���ǣ����dz�ȥ�����������ʣ�����___________________��
��4����Ӧ��������ͭ����ʯ�Һ�ˮ�Ʊ�������Һ���仯ѧ����ʽΪ������_____________________������___________________________��
������ɲⶨ
��������:ʯ��Ļ�ѧʽ�ɱ�ʾΪaCuCO3bCu(OH)2��Cu(OH)2�ķֽ��¶�Ϊ66�桫68�棬CuCO3�ķֽ��¶�Ϊ200�桫220�档Ϊ�ⶨ����ɣ�С��ͬѧ��ȡʯ����Ʒ34.6g������ͼװ�ý���ʵ�顣
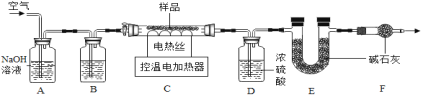
��5��ϴ��ƿA������������Һ��������_____��B����װҺ��Ϊ_____��
��6���ֿ���Cװ���е��¶�Ϊ250���ʯ������ȷֽ⣬ֱ��Cװ����ʣ������������ٱ仯Ϊֹ���ٻ���ͨ��һ��ʱ���������ȴ��װ��D����1.8g��װ��E����8.8g��ͨ������ɵã�a��b=_____��
��7����ȱ��Fװ�ã���õ�a��b_____��ѡ����ƫ��������ƫС����������������
������ˮ̽��
����ͭ�������Ȼ���ʧȥ�ᾧˮ��ȡ����CuSO45H2O����2.50g��������ͼʵ��װ��C�н��м��ȣ��ⶨ�����������µı仯�����ͼ��ʾ��
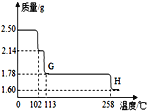
��8��G�����Ļ�ѧʽ��_____��
��9��G��H������������_____��
��10����CuSO45H2O������ȵ�570��ֽ�õ�����Ҫ�����Ǻ�ɫ��ĩ�����һ���������ˮ�������÷�Ӧ�Ļ�ѧ����ʽΪ��_____��