题目内容
【题目】学习了酸和碱的化学性质后,实验小组的同学利用氢氧化钠与稀硫酸进行实验,反应的化学方程式_____,同学们对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究。
(提出问题1)溶液中的溶质是什么物质?
(进行猜想1)(1)甲同学认为溶液中的溶质只有Na2SO4。
(2)乙同学认为溶液中的溶质是Na2SO4和H2SO4
(3)丙同学认为溶液中的溶质是Na2SO4和NaOH
(查阅资料)Na2SO4溶液显中性。
(实验验证1)实验操作①:取少许反应后的溶液于试管中,将打磨光亮后的铝片放入试管的溶液中。观察到铝片逐渐溶解,并有大量气泡冒出。实验结论:猜想(2)成立。
实验操作②:取少许反应后的溶液于试管中,向试管中滴加几滴无色酚酞溶液。观察到溶液变成_____色。实验结论:猜想(3)成立。
(反思交流)(1)打磨铝片的目的是_____。
(2)对于实验出现不同的结论,同学们咨询老师后得知:铝与氢氧化钠反应也会有气体产生,经过讨论,同学们一致认为反应后的溶质由_____(写化学式)组成。
(提出问题2)铝与氢氧化钠反应生成的气体可能是什么?
(进行猜想2)同学们认为产生的气体可能是氢气,一定不是CO 2,原因是_____。
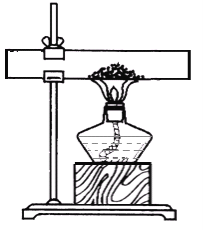
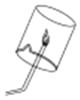
(实验验证2)实验小组的同学们设计如图所示实验装置检验生成的气体后,验纯后点燃气体,观察到_____,证明反应生成的气体是氢气。
(知识拓展)生活中能否用铝制品来盛放强碱性溶液?_____(填“能”或“不能”)。
【答案】2NaOH+H2SO4=Na2SO4+2H2O 红 除去铝片表面的氧化物 Na2SO4、NaOH 反应物中含有氢元素,不含碳元素 气体燃烧,产生淡蓝色火焰,烧杯内壁出现水雾 不能
【解析】
氢氧化钠与稀硫酸反应生成硫酸钠和水;故填:2NaOH+H2SO4=Na2SO4+2H2O;
[实验验证1]实验操作②:取少许反应后的溶液于试管中,向试管中滴加几滴无色酚酞溶液。若观察到溶液变成红色,说明溶液显碱性吗,即猜想(3)成立;故填:红;
[反思交流](1)铝的化学性质活泼,在空气中能与氧气反应生成致密的氧化铝薄膜,所以为了除去铝片表面的氧化物,要打磨铝片;故填:除去铝片表面的氧化物;
(2)该溶液能使无色酚酞变红色,且铝和氢氧化钠反应会生成偏铝酸钠和氢气,所以同学们一致认为反应后的溶质由Na2SO4、NaOH组成;故填:Na2SO4、NaOH;
[进行猜想2]由质量守恒定律可知,化学反应前后元素的种类不变,所以产生的气体可能是氢气,一定不是CO2,故填:反应物中含有氢元素,不含碳元素;
[实验验证2]氢气具有可燃性,燃烧时产生淡蓝色火焰,若在火焰上方罩一个干燥的冷烧杯,烧杯内壁出现水雾;故填:气体燃烧,产生淡蓝色火焰,烧杯内壁出现水雾;
[知识拓展]因为铝能与氢氧化钠反应,所以生活中不能用铝制品来盛放强碱性溶液;故填:不能。