题目内容
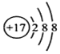
【题目】烹饪鱼时通常将鱼煎过后,再加少许食醋和酒,这是因为它们可以反应生成具有特殊香味的乙酸乙酯(化学式为C4H8O2),每个乙酸乙酯分子是由____个原子构成的,乙酸乙酯的相对分子质量是________在乙酸乙酯中碳元素和氧元素的最简质量比是 ______;17.6g乙酸乙酯中所含氧元素的质量为___________g 。
【答案】14 88 3:2 6.4
【解析】
1个乙酸乙酯分子由4个碳原子、8个氢原子和2个氧原子构成的,则每个乙酸乙酯分子是由14个原子构成.
乙酸乙酯的相对分子量为12×4+8+16×2=88;在乙酸乙酯中碳元素和氧元素的最简质量比是(12×4):(16×2)=3:2;17.6g乙酸乙酯中所含氧元素的质量为17.6g×![]() ×100%=6.4g.
×100%=6.4g.

【题目】下水道堵塞是日常生活中经常遇到的问题,下水管里的淤积物主要为油污、食物残渣、毛发等。“管道通”可使堵塞的管道畅通无阻。化学兴趣小组对“管道通”中的物质进行了探究:

(查阅资料)
(1)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西,常用于疏通管道。
(2)铝粉呈银白色。铝粉与强酸、强碱溶液都能迅速反应放出氢气,同时放出大量热。
①铝与盐酸反应的化学方程式为_____。
②铝与氢氧化钠溶液反应的化学方程式为_____=2NaAlO2+3H2↑
(1)(猜想与验证)打开一盒“管道通”,内有一袋白色固体颗粒和一袋银白色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
实验操作 | 实验现象 |
①将几粒白色颗粒放在表面皿上,露置在空气中片刻。 | _____ |
②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 | 试管外壁温度升高 |
③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 | 羊毛线缩小 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银白色粉末为铝粉。
实验操作 | 实验现象 |
①取少量该粉末于洁净的试管中,滴加稀盐酸,用手触摸 试管外壁,点燃反应产生的气体 | 产生大量气泡,试管外壁温度明显升高,气体燃烧产生淡蓝色火焰。 |
②取少量该粉末于洁净的试管中,滴加_____,用手触摸 试管外壁,点燃反应产生的气体 |
结论:银白色粉末为铝粉。
(应用)
(2)使用“管道通”时,先将银白色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口。管道内可能出现的现象是_____.(填序号)
A.管道内温度明显升高
B.产生大量气体
C.管道被疏通
(3)“管道通”内的两种物质必须密封保存,否则会发生变质。用化学方程式表示其中的原因:_____、_____。
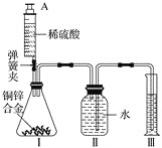
【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
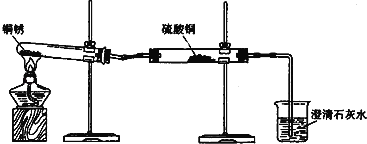
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
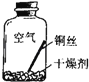
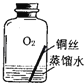
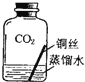
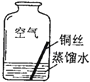
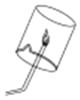
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|
【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.