题目内容
【题目】金属铁是当今用途最广的金属,现研究铁的冶炼。
(研究一)实验室模拟炼铁(装置如下图)。
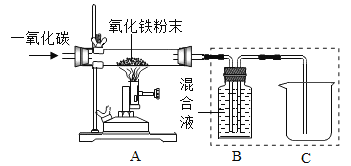
己知:B装置中的液体为过量的氢氧化钠与氢氧化钙混合液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。请回答下列问题:
(1)实验过程中A处玻璃管中的实验现象:________。
(2)写出B处反应的化学方程式:________。
(3)实验装置按图连接,请将以下四步按正确操作步骤排序:________(填序号)。
A点燃A处酒精喷灯
B通入CO
C停止通入CO
D熄灭酒精喷灯
(4)实验装置图中虚线框内装置起到的作用有_________(填序号)。
A收集一氧化碳
B吸收二氧化碳
C检验二氧化碳
(5)己知此反应过程中温度不同,可能生成铁的不同的氧化物。原固体Fe2O3质量为48.0g,现用热分析仪记录CO与Fe2O3进行反应时有关数据,得到固体质量与反应温度的关系曲线如下图所示:
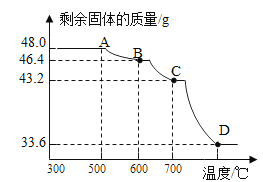
根据图象分析,写出B点时固体成分的化学式_________。
(研究二)工业炼铁(装置如下图)

(1)焦炭是炼铁的重要原料之一,其作用有___________。
(2)炼铁高炉内发生的主要化学反应①的化学方程式为____________。
(3)“高炉气体”中除二氧化碳外,体积含量最多的气体是___________。
(4)为测定产物生铁中单质铁的质量分数,某兴趣小组取用10g生铁样品,把100g稀硫酸分四次加入样品中(假设样品中除单质铁外,其他成份不与硫酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第一次加入25g | 7.2g |
第二次加入25g | 4.4g |
第三次加入25g | 1.6g |
第四次加入25g | 0.2g |
①从以上数据可知,第_________次生铁样品中的单质铁已完全反应。
②生铁样品中单质铁的质量分数=__________。
③所用稀硫酸的H2SO4质量分数。(列式计算)_______
【答案】红棕色固体变成黑色 CO2+2NaOH═Na2CO3+H2O、CO2+Ca(OH)═CaCO3![]() +H2O BADC ABC Fe3O4 提供高温、生成一氧化碳 Fe2O3+3CO
+H2O BADC ABC Fe3O4 提供高温、生成一氧化碳 Fe2O3+3CO![]() 2Fe+3CO2 氮气 四 98% 18.9%
2Fe+3CO2 氮气 四 98% 18.9%
【解析】
[研究一]
(1)一氧化碳和氧化铁在高温的条件下会生成铁和二氧化碳,所以A中的现象:红棕色固体变成黑色,故填:红棕色固体变成黑色;
(2)B装置中的液体为过量的氢氧化钠与氢氧化钙混合液,二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,故填:CO2+2NaOH═Na2CO3+H2O、CO2+Ca(OH)═CaCO3![]() +H2O;
+H2O;
(3)为保证安全和实验成功,实验的操作步骤为:通入CO气体、点燃A处酒精喷灯、熄灭酒精喷灯、停止通入CO气体,故填:BADC;
(4)氢氧化钠、氢氧化钙会与二氧化碳反应,一氧化碳有毒,需要处理,所以实验装置图中采用虚线框内的装置,其作用有:收集一氧化碳,吸收二氧化碳,检验二氧化碳,故选:ABC;
(5)铁的氧化物有:FeO、Fe3O4、Fe2O3,B点铁元素的质量等于A点铁元素的质量,为![]() ,B点氧元素的质量为:46.4g-33.6g=12.8g,铁、氧原子个数比为:
,B点氧元素的质量为:46.4g-33.6g=12.8g,铁、氧原子个数比为: ,故B点时固体成分的化学式为:Fe3O4。
,故B点时固体成分的化学式为:Fe3O4。
[研究二]
(1)焦炭是炼铁的重要原料之一,其作用有燃烧提供高温,生成一氧化碳使氧化铁转化为铁,故填:提供高温、生成一氧化碳;
(2)炼铁高炉内化学反应①是氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2,故填:Fe2O3+3CO
2Fe+3CO2,故填:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)“高炉气体”中除二氧化碳外,体积含量最多的气体是氮气。故填:氮气;
(4)①第一、二、三次加入25g稀硫酸,固体质量都减少2.8g,第四次加入25g稀硫酸,固体质量减少1.4g,说明生铁样品中的单质铁已完全反应,故填:四;
②生铁样品中单质铁的质量分数=![]() =98%。故填:98%;
=98%。故填:98%;
③由表格数据可知,每25g稀硫酸可反应铁的质量为:10g-7.2g=2.8g;
设所用稀硫酸的H2SO4质量分数为x

x≈18.9%
答:所用稀硫酸的H2SO4质量分数为18.9%。

 阅读快车系列答案
阅读快车系列答案