题目内容
【题目】张玉同学在实验室发现了一瓶过氧化氢溶液,根据瓶上的标签得知该过氧化氢溶液中过氧化氢的质量分数(即溶液中过氧化氢的质量百分数)为3%,他称取了该过氧化氢溶液68. 0g倒入烧杯中,然后向其中加入0. lg二氧化锰,测得反应前后烧杯内物质总质量随时间变化关系如图所示。计算:

(1)充分反应后。生成氧气的质量是______;二氧化锰的质量是_______g;
(2)68.0g该过氧化氢溶液中过氧化氢的质量是_______________? (请写出计算过程)
(3)该过氧化氢溶液中过氧化氢的实际质量分数__________3% (填“>”、“=”或“<”)。
【答案】0.8g 0.1 1.7g。 <
【解析】
(1)由题意,过氧化氢在二氧化锰做催化剂的条件下分解生成水和氧气,反应前后烧杯内物质总质量的减少量即为生成氧气的质量,则生成氧气的质量是68.1g-67.3g=0.8g;二氧化锰是反应的催化剂,反应前后质量和化学性质保持不变,反应后二氧化锰的质量是0.1g;
(2)设68.0g该过氧化氢溶液中过氧化氢的质量为x,则有:
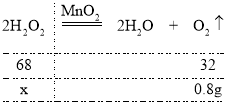
由![]()
解得x=1.7g
答:68.0g该过氧化氢溶液中过氧化氢的质量是1.7g。
(3)该过氧化氢溶液中过氧化氢的实际质量分数为![]() ,小于3%。
,小于3%。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】金属铁是当今用途最广的金属,现研究铁的冶炼。
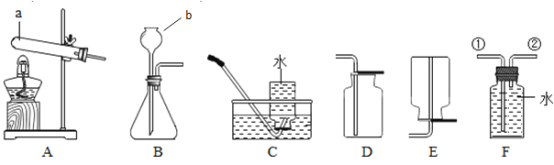
(研究一)实验室模拟炼铁(装置如下图)。
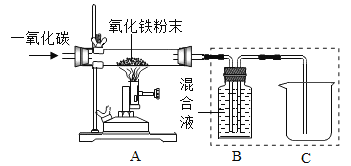
己知:B装置中的液体为过量的氢氧化钠与氢氧化钙混合液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。请回答下列问题:
(1)实验过程中A处玻璃管中的实验现象:________。
(2)写出B处反应的化学方程式:________。
(3)实验装置按图连接,请将以下四步按正确操作步骤排序:________(填序号)。
A点燃A处酒精喷灯
B通入CO
C停止通入CO
D熄灭酒精喷灯
(4)实验装置图中虚线框内装置起到的作用有_________(填序号)。
A收集一氧化碳
B吸收二氧化碳
C检验二氧化碳
(5)己知此反应过程中温度不同,可能生成铁的不同的氧化物。原固体Fe2O3质量为48.0g,现用热分析仪记录CO与Fe2O3进行反应时有关数据,得到固体质量与反应温度的关系曲线如下图所示:
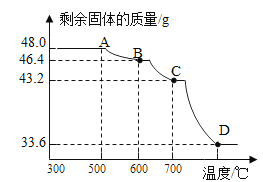
根据图象分析,写出B点时固体成分的化学式_________。
(研究二)工业炼铁(装置如下图)

(1)焦炭是炼铁的重要原料之一,其作用有___________。
(2)炼铁高炉内发生的主要化学反应①的化学方程式为____________。
(3)“高炉气体”中除二氧化碳外,体积含量最多的气体是___________。
(4)为测定产物生铁中单质铁的质量分数,某兴趣小组取用10g生铁样品,把100g稀硫酸分四次加入样品中(假设样品中除单质铁外,其他成份不与硫酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第一次加入25g | 7.2g |
第二次加入25g | 4.4g |
第三次加入25g | 1.6g |
第四次加入25g | 0.2g |
①从以上数据可知,第_________次生铁样品中的单质铁已完全反应。
②生铁样品中单质铁的质量分数=__________。
③所用稀硫酸的H2SO4质量分数。(列式计算)_______