题目内容
【题目】写出下列反应的化学方程式并按要求填空:
(1)铜在空气中加热:_______,该实验观察到的实验现象是_______。
(2)丙烷(C3H8)在空气中完全燃烧:_______,与不完全燃烧相比,燃料发生完全燃烧的优点有_______。
【答案】2Cu+O2![]() 2CuO 红色固体变黑 C3H8+5O2
2CuO 红色固体变黑 C3H8+5O2![]() 3CO2+4H2O 减少环境污染等
3CO2+4H2O 减少环境污染等
【解析】
(1)铜和氧气在加热的条件下生成氧化铜,化学方程式为:2Cu+O2![]() 2CuO,该实验观察到的实验现象是红色固体变黑;故填:2Cu+O2
2CuO,该实验观察到的实验现象是红色固体变黑;故填:2Cu+O2![]() 2CuO;红色固体变黑;
2CuO;红色固体变黑;
(2)丙烷在空气中完全燃烧生成二氧化碳和水,反应的化学方程式为:C3H8+5O2![]() 3CO2+4H2O;丙烷不完全燃烧会生成一氧化碳,一氧化碳有毒会污染空气,与不完全燃烧相比,燃料发生完全燃烧的优点是能减少环境的污染等。
3CO2+4H2O;丙烷不完全燃烧会生成一氧化碳,一氧化碳有毒会污染空气,与不完全燃烧相比,燃料发生完全燃烧的优点是能减少环境的污染等。
故填:C3H8+5O2![]() 3CO2+4H2O;减少环境污染等。
3CO2+4H2O;减少环境污染等。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】化学兴趣小组发现,将氧化铁加入到过氧化氢溶液中,过氧化氢溶液的分解速率加快。该小组成员进行了如下探究:
(提出问题)氧化铁能不能作为过氧化氢溶液分解的催化剂呢?
(作出猜想)氧化铁能作为过氧化氢溶液分解的催化剂。
(实验验证)同学们设计了实验装置并进行了气体的制取和测量实验。实验时均以生成40mL气体为标准,相关实验数据记录如下表:
实验序号 | 过氧化氢溶液浓度% | 过氧化氢溶液体积mL | 过氧化氢溶液温度℃ | 氧化铁质量g | 收集40mL氧气所用时间s |
① | 5 | 10 | 20 | 0 | 128 |
② | 5 | 10 | 20 | 0.5 | 28 |
③ | 15 | 10 | 20 | 0.5 | 10 |
④ | 5 | 10 | 50 | 0 | 55 |
(1)通过实验①和④可知,过氧化氢溶液的分解速率与温度的关系是_____;定量比较反应快慢,除了上述实验中方法外,还可以采用的方法:_____。
(2)通过实验_____和_____对比可知,加入氧化铁后过氧化氢溶液的分解速率加快,若要证明氧化铁是过氧化氢溶液的分解的催化剂,还需要证明它在反应前后的_____和_____没有发生变化。
(3)如果将一定量的15%的过氧化氢溶液加水稀释,其他条件不变的情况下,产生的氧气的总量会_____(填“增大”“不变”或“减小”)。
(4)实验证明氧化铁也可以作为过氧化氢溶液的分解的催化剂,请你写出这个反应的文字表达式:_____。
(5)上述实验验证了一些影响过氧化氢溶液的分解速率的因素,那么你认为过氧化氢溶液的分解速率还可能与_____因素有关,你的实验验证方案是_____。
【题目】金属铁是当今用途最广的金属,现研究铁的冶炼。
(研究一)实验室模拟炼铁(装置如下图)。
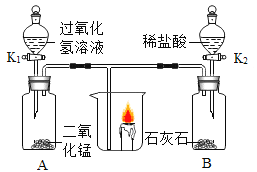
己知:B装置中的液体为过量的氢氧化钠与氢氧化钙混合液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。请回答下列问题:
(1)实验过程中A处玻璃管中的实验现象:________。
(2)写出B处反应的化学方程式:________。
(3)实验装置按图连接,请将以下四步按正确操作步骤排序:________(填序号)。
A点燃A处酒精喷灯
B通入CO
C停止通入CO
D熄灭酒精喷灯
(4)实验装置图中虚线框内装置起到的作用有_________(填序号)。
A收集一氧化碳
B吸收二氧化碳
C检验二氧化碳
(5)己知此反应过程中温度不同,可能生成铁的不同的氧化物。原固体Fe2O3质量为48.0g,现用热分析仪记录CO与Fe2O3进行反应时有关数据,得到固体质量与反应温度的关系曲线如下图所示:
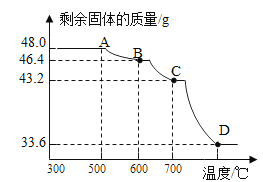
根据图象分析,写出B点时固体成分的化学式_________。
(研究二)工业炼铁(装置如下图)

(1)焦炭是炼铁的重要原料之一,其作用有___________。
(2)炼铁高炉内发生的主要化学反应①的化学方程式为____________。
(3)“高炉气体”中除二氧化碳外,体积含量最多的气体是___________。
(4)为测定产物生铁中单质铁的质量分数,某兴趣小组取用10g生铁样品,把100g稀硫酸分四次加入样品中(假设样品中除单质铁外,其他成份不与硫酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀硫酸的用量 | 剩余固体的质量 |
第一次加入25g | 7.2g |
第二次加入25g | 4.4g |
第三次加入25g | 1.6g |
第四次加入25g | 0.2g |
①从以上数据可知,第_________次生铁样品中的单质铁已完全反应。
②生铁样品中单质铁的质量分数=__________。
③所用稀硫酸的H2SO4质量分数。(列式计算)_______