题目内容
【题目】小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中碳酸钙的质量分数进行检测,采用的办法如下:取用8 g这种石灰石样品,把40 g稀盐酸分4次加入,测量过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。请计算:
序号 | 加入稀盐酸质量/g | 剩余固体质量/g |
第1次 | 10 | 5.5 |
第2次 | 10 | m |
第3次 | 10 | 1.2 |
第4次 | 10 | 1.2 |
(1)下表中m的数值应该为_________ ?
(2)样品中碳酸钙的质量分数是____________?
【答案】3g 85%
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,根据表中提供的数据和反应的化学方程式利用进行相关方面的计算和判断。
(1)第一次加入10克稀盐酸,固体减少8g-5.5g=2.5g,后面加入稀盐酸固体还会减少,说明每10克稀盐酸能够消耗2.5克碳酸钙,故m=5.5g-2.5g=3g。
(2)第3次和第4次加入稀盐酸质量和剩余固体完全一样,说明固体中有1.2克杂质不能和稀盐酸反应,剩余1.2g固体是杂质的质量,样品中碳酸钙的质量分数是![]() 。
。
答:样品中碳酸钙的质量分数是85%。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】利用干燥而纯净的氢气还原氧化铜的实验测定水的质量组成。其装置如下图所示:完全反应后其实验测定的数据如下表所列(必要时装置可重复使用)。
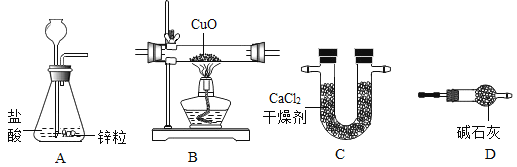
实验前 | 实验后 | |
(氧化铜+玻璃管)的质量/g | 75.6 | 69.2 |
(氯化钙+U型管)的质量/g | 100.8 | 118.0 |
试回答:
(1)A中反应容器的仪器名称是:__________。
(2)装置正确的连接顺序(自左向右)是(填字母)A-________--________--________--________。
(3)连接好装置并检查气密性装好药品后在加热前的必要操作是:________。
(4)生成水中氢元素的质量为________________________。
(5)如果没有实验装置D,实验测得水中氢的质量________(填“偏大”“偏小”或者“不变”)。
(6)本实验装置从安全角度考虑存在的缺陷是:________________________。