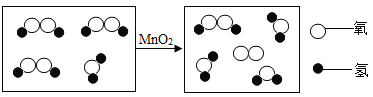
题目内容
【题目】下列化学方程式符合题意且书写正确的是( )
A. 酸雨的pH小于5.6的原因:CO2+H2O═H2CO3
B. 医疗上用氢氧化镁中和过多胃酸:Mg(OH)2+H2SO4═MgSO4+2H2O
C. 用一氧化碳还原氧化铁炼铁:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. 证明铁是金属活动性顺序表中氢之前的金属:2Fe+6HCl═2FeCl3+3H2↑
【答案】C
【解析】
A、根据酸雨形成的原因进行分析;
B、根据胃酸的主要成分是盐酸进行分析;
C、根据方程式的书写规则进行分析;
D、根据铁在置换反应中显+2价进行分析。
A、酸雨形成的主要原因是二氧化硫和空气中的水蒸气、氧气共同作用形成的硫酸,正确的方程式为:![]() ,故A错误;
,故A错误;
B、胃酸的主要成分是盐酸,不是硫酸,正确的方程式为:![]() ,故B错误;
,故B错误;
C、该方程式应用原理正确,化学式书写符合客观规律,满足质量守恒定律,故C正确
D、铁在置换反应中显+2价而不是+3价,正确的方程式为:![]() ,故D错误。
,故D错误。
故选:C。

【题目】在小英家的仓库里,堆放着一袋袋化肥一一碳酸氢铵( NH4HCO3).过了一个夏天,小英发现这种化肥所持有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了,检查发现变少的化肥包装袋没有密封,化肥也没有撒落在地上,更没有人进过仓库开袋使用。
为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味.粉末为什么会消失呢?
(1)(提出问题)碳酸氢铵粉末消失的原因是什么?
(2)(猜想)①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和一些氧化物。
(3)(查阅资料)①碳酸氢铵属于氨肥,不具有升华的性质,说明上述猜想__________ (填序号)不成立;②氨气(化学式NH3)具有特殊的刺激性气味,极易溶于水,其水溶液是碱性,但干燥的氨气不能使干燥的红色石蕊试剂变蓝;③NO2为红棕色气体。NO为无色气体,在空气中易发生反应:2NO+O2=2NO2
(4)(实验操作,现象与结论)
实验操作 | 实验现象 | 实验结论 |
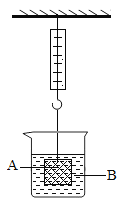
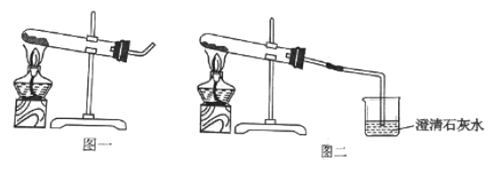
①取适量碳酸氢铵于试管中加热,如图一所示,将干燥的红色石蕊试纸接近导管口 | 产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 | 分解产物中有______,没有__________ |
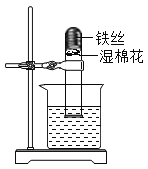
②按如图二所示装置继续实验,直到反应完全 | 澄清石灰水变浑浊 | 分解产物中有__________ |
(5)(应用)①利用氨气的化学性质,请写出实验室检验氨气的方法(写出实验操作、现象、结论):________________________________________;
②如果你家里有碳酸氢铵化肥,你应该如何保存? ______________________________。