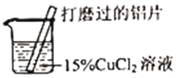题目内容
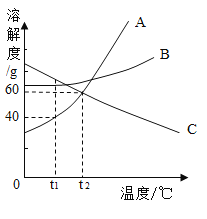
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题。

(1)A点时,甲、乙、丙三种物质的溶解度的大小关系为_____。
(2)在30℃时,向30g甲物质中加入50g水,充分溶解后所得溶液是 _____(填“饱和”或“不饱和”)溶液,所得溶液质量为_____g。
(3)若乙中混有少量甲,最好采用_____(填“降温结晶”或“蒸发结晶”)的方法提纯乙。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数由大到小的关系是_____。
(5)将100g 10%的甲溶液稀释到4%需加_____g水。
【答案】甲=乙丙 饱和 72.5 蒸发结晶 乙>甲>丙 150
【解析】
(1)A点时,甲、乙溶解度曲线相交,并在并溶解度曲线上方,此时甲、乙、丙三种物质的溶解度的大小关系为甲=乙丙。
(2)在30℃时,甲溶解度为45g,向30g甲物质中加入50g水,可充分溶解22.5g甲物质,所得溶液是饱和溶液,所得溶液质量为22.5g+50g=72.5g。
(3)由于乙的溶解度随温度的变化不大,甲的溶解度水温度的升高而增大,若乙中混有少量甲,最好采用蒸发结晶的方法提纯乙。
(4)将30℃时,甲、乙、丙三种物质的饱和溶液降温到10℃,三种溶液中溶质的质量分数由大到小的顺序为:乙>甲>丙,因为降温后乙的溶解度大于甲,丙溶液的溶质质量分数不变,还是按30℃时的溶解度计算,还是最小。
(5)溶液稀释,溶质质量不变,将100g 10%的甲溶液稀释到4%,设需加水的质量为x,则:![]() ,解得x=150g;故将100g 10%的甲溶液稀释到4%需加150g水。
,解得x=150g;故将100g 10%的甲溶液稀释到4%需加150g水。

【题目】实验室有一瓶标签破损的硫酸。为测定该瓶硫酸溶液的溶质质量分数,小强同学在烧杯中加入50g该硫酸,然后向烧杯中滴加溶质质量分数为10%的氢氧化钠溶液,边滴加边搅拌,随着氢氧化钠溶液的滴入,溶液的pH变化情况如下表所示,请分析并计算:
氢氧化钠溶液的质量/g | 溶液的pH | 所得溶液 |
30 | pH<7 | a |
40 | pH =7 | b |
45 | pH>7 | c |
(1)a、b、c三种溶液中只含一种溶质的是________。
(2)该瓶硫酸溶液的溶质质量分数是多少____?(写出解题过程)(H2SO4+2NaOH==Na2SO4+2H2O)
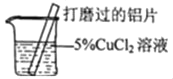
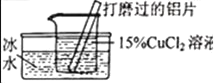
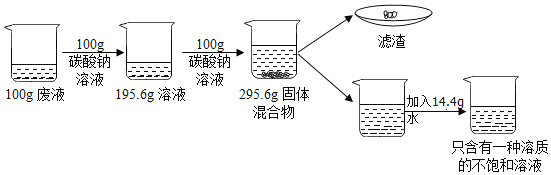
【题目】某化学兴趣小组的同学在实验室对铝与氯化铜溶液的反应进行了如下探究,请回答相关问题。
实验操作 | 实验现象 |
| ①有红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是_____。
(2)现象①③的红色物质为铜,生成铜的化学方程式为_____。
(3)收集逸出的无色气体,经检验具有可燃性,该气体为_____(写化学式),说明氯化铜溶液显_____性。
(查阅资料)氯化亚铜(CuC1)是一种微溶于水的白色固体,在空气中易被氧化成褐色的Cu(OH)Cl。
(4)取杯底的白色沉淀暴露在空气中,一段时间后观察到变成褐色,说明白色物质为氯化亚铜。该变色反应的产物只有 Cu(OH)Cl,反应的化学方程式为_____。
(发现问题)氯化亚铜的生成与反应条件有关吗?
(提出猜想)猜想I:与反应物的浓度有关;猜想Ⅱ:与反应的_____有关。
(实验探究)
实验设计 |
|
|
实验现象 | 有红色沉淀和无色气体生成,无白色沉淀生成。 | 有红色沉淀和无色气体生成,_____ |
实验结论 | 猜想I成立 | 猜想Ⅱ成立 |
(拓展与思考)氯化亚铜是否是反应生成的铜与溶液中的氯化铜发生 Cu+CuCl2=2CuCl反应生成的?可用试管取15%的氯化铜溶液,向其中加入_____并加热的方法来验证。
【题目】某化学课堂进行“酸碱中和反应”实验,请你和他们一起完成实验探究。
[实验]将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_______________。
[查阅资料]CaC12溶液显中性,Ca(OH)2溶液显碱性的原因是溶液含有_____________(用微粒符号表示)。
[提出问题]部分同学产生了疑问:反应后溶液中溶质的成分是什么?
[猜想与假设]针对疑问,甲组同学猜想如下:
猜想I:只有CaC12
猜想II:有_____________
猜想III:有CaCl2和Ca(OH)2
猜想IV:有CaCl2、HCl和Ca (OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是________________。
[实验探究]为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加酚酞溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | _____________ | _____________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca (OH)2 | 溶液中含有Ca (OH)2 | 溶液中含有Ca (OH)2 |
[得出结论]通过探究,全班同学一致确定猜想III是正确的。
[评价反思](1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因___________________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑_____________。
【题目】下表是NaCl、 KClO3在不同温度下的溶解度(单位: g)
温度(°C) | 0 | 20 | 40 | 60 | 80 | 100 |
S(NaC1) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
S(KClO3) | 3.3 | 7.3 | 13.9 | 23.8 | 37.5 | 56.3 |
(1)20°C时,NaCl的溶解度为________;
(2)40°C时,将10gKClO3放入100g水中充分溶解,所得溶液溶质质量分数为________;(精确到0.1% )
(3)“海水晒盐”利用的方法是__________;(填“蒸发结晶”或“降温结晶”) ;
(4)实验室可以用加热一定质量的氯酸钾与二氧化锰的混合物制取氧气,根据需要产生9.6g氧气后停止加热,则发生反应的氯酸钾的质量为________g.反应后剩余固体的成分可能为________。
(5)工业上用氯化钠溶液制备氯酸钾,主要流程如下:
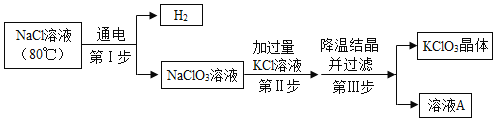
(第II步中发生的反应: ![]() )
)
①第I步反应的化学方程式为_________。
②溶液A中含有的溶质有__________(填化学式) .