题目内容
【题目】溶液在日常生活及工农业生产中无处不在。
(1)下列关于溶液的说法正确的是_____。
A溶液一定是无色透明的
B溶液都是均一、稳定的混合物
C形成溶液的溶质都是固体
D同种溶质的饱和溶液都比不饱和溶液浓度大
(2)如图为甲、乙、丙三种物质的溶解度曲线。
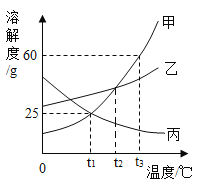
①t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序为_____(用“>”“≥”“=”“≤”或“<”表示,下同)
②t2℃时三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为_____。
③由图所知,甲的溶解度大于丙、不大于乙的温度(T)范围为_____。
④将t3℃时80g甲的饱和溶液降温到t1℃,析出晶体的质量为_____。
(3)小海同学通过实验探究氢氧化钠和氯化钙能否发生反应,查阅资料得知相关物质的溶解度如下表所示:
物质 | 氢氧化钠 | 氯化钙 | 氯化钠 | 氢氧化钙 |
20℃时溶解度/g | 109 | 74.5 | 36 | 0.19 |
于是小海同学将20%的氢氧化钠溶液与30%的氯化钙溶液混合,观察到浑浊现象。试写出该反应的化学方程式_____。
【答案】B 乙>甲=丙 乙>甲>丙 t1℃<T≤t2℃ 17.5g 2NaOH+CaCl2=Ca(OH)2↓+2NaCl
【解析】
(1)A.溶液不一定是无色的,比如硫酸铜溶液是蓝色的,错误;
B.溶液都是均一、稳定的混合物,正确;
C.形成溶液的溶质不都是固体,比如酒精溶液溶质是液体,错误;
D.同种溶质的饱和溶液在同温下比不饱和溶液浓度大,错误;
故填:B;
(2)①据图可以看出,在t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序为乙>甲=丙,故填:乙>甲=丙;
②t2℃时三种物质的饱和溶液降温到t1℃,乙和甲会析出晶体而溶质质量分数减小,丙的不变,故所得溶液的溶质质量分数由大到小的顺序为乙>甲>丙,故填:乙>甲>丙。
③据图可以看出,甲的溶解度大于丙、不大于乙的温度(T)范围为t1℃<T≤t2℃,故填:t1℃<T≤t2℃。
④将t3℃时甲的溶解度为60g,t1℃时甲的溶解度为25g,故80g甲的饱和溶液降温到t1℃,析出晶体的质量为(60g﹣25g)÷2=17.5g,故填:17.5g。
(3)20%的氢氧化钠溶液与30%的氯化钙溶液混合,观察到浑浊现象,是因为氢氧化钠和氯化钙结合形成了微溶于水的氢氧化钙的缘故,该反应的化学方程式 2NaOH+CaCl2=Ca(OH)2↓+2NaCl.故填:2NaOH+CaCl2=Ca(OH)2↓+2NaCl。

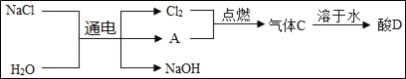
【题目】有一包白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某合作学习小组设计方案并进行了如下实验:
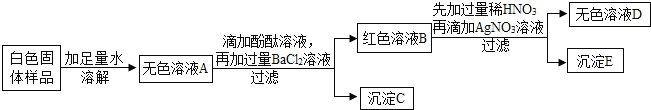
(1)小晶同学通过上述实验推知:白色固体样品中一定不含有____________(用化学式表示,下同)。
(2)为确定白色固体样品中可能存在的物质,小燕对沉淀C进行实验。
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量稀硝酸。 | ___________。 | 白色固体样品中一定含有碳酸钠和硫酸钠。 |
(3)上述实验中红色溶液B的溶质,除酚酞外,还一定含有______________________,用化学方程式表示红色溶液B变成无色溶液D的原因:_____________________________。
(4)小虎同学认为白色固体中还有物质不能确认其是否存在,经过小组讨论后得出一致意见:如要确认,只需将上述实验方案中所加的一种试剂换为另一种试剂即可,你认为修改方案为_______________。