题目内容
【题目】黄铜是由铜、锌单质组成的合金,某企业要求含锌量介于25%~35%的黄铜属于合格品。现取黄铜样品10g,逐滴加入溶质质量分数为9.8%的稀硫酸至恰好完全反应生成气体的质量为0.1g。求:
(1)该黄铜样品中锌的质量分数是否满足企业需要。______
(2)将反应后的溶液蒸发掉12.9g水没有晶体析出,求所得溶液中溶质质量分数。______
【答案】黄铜样品中锌的质量分数满足企业需要 20%
【解析】
(1)设消耗的硫酸溶液的质量为x,生成的硫酸锌的质量为y,参加反应的锌的质量为z

![]()
x=50g
y=8.05g
z=3.25g
该黄铜样品中锌的质量分数为![]() ×100%=32.5%,
×100%=32.5%,
含锌量介于25%~35%的黄铜属于合格品;
(2)将反应后的溶液蒸发掉12.9g水没有晶体析出,所得溶液中溶质质量分数为![]() ×100%=20%;
×100%=20%;
答:(1)该黄铜样品中锌的质量分数满足企业需要;
(2)所得溶液中溶质质量分数为20%。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】溶液在日常生活及工农业生产中无处不在。
(1)下列关于溶液的说法正确的是_____。
A溶液一定是无色透明的
B溶液都是均一、稳定的混合物
C形成溶液的溶质都是固体
D同种溶质的饱和溶液都比不饱和溶液浓度大
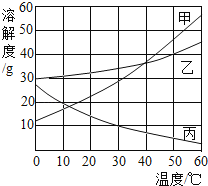
(2)如图为甲、乙、丙三种物质的溶解度曲线。
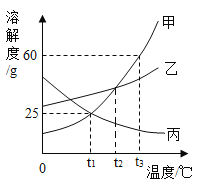
①t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序为_____(用“>”“≥”“=”“≤”或“<”表示,下同)
②t2℃时三种物质的饱和溶液降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为_____。
③由图所知,甲的溶解度大于丙、不大于乙的温度(T)范围为_____。
④将t3℃时80g甲的饱和溶液降温到t1℃,析出晶体的质量为_____。
(3)小海同学通过实验探究氢氧化钠和氯化钙能否发生反应,查阅资料得知相关物质的溶解度如下表所示:
物质 | 氢氧化钠 | 氯化钙 | 氯化钠 | 氢氧化钙 |
20℃时溶解度/g | 109 | 74.5 | 36 | 0.19 |
于是小海同学将20%的氢氧化钠溶液与30%的氯化钙溶液混合,观察到浑浊现象。试写出该反应的化学方程式_____。